Wyss研究所的一项研究工作由其核心成员DavidWalt博士和George Church博士领导,开发了新的工具来测量和分离微小的膜包裹的细胞外囊泡 (EV),这些细胞外囊泡由体内所有细胞脱落。EV从其起源组织携带分子货物,可用于诊断疾病,包括神经系统疾病和脑癌。该团队在Chan Zuckerberg Initiative的神经退行性挑战网络和Open Philanthropy的支持下,寻求在帕金森氏症和阿尔茨海默氏症早期以及发展过程中发现其迹象的策略。他们的这项工作发表在eLife杂志上,能够系统分析血浆和脑脊液中的EV分离方法,这是诊断大脑和其他器官疾病的重要一步。
“需要进行敏感性测试,以便能够从难以到达且目前需要侵入性活检程序的身体部位提供有关许多疾病状态的可操作分子信息。这样的测试不仅可以让临床医生尽早开始治疗,可以最大限度地发挥其效果,而且更重要的是,随着时间的推移,还可以在个体患者的临床试验中跟踪新候选药物效果。”这项研究的通讯作者Walt说。
由于无法从活着的患者身上获得脑活检信息,因此在许多没有可用诊断分析的神经系统疾病中,这项工作将显著具有益处。
多年来,研究人员一直在设想“液体活检”从微小的 EV 中提取有关难以接近器官的分子信息,这些 EV 直径仅约100 nm,在血液中循环,并含有蛋白质、脂质和核酸,如从细胞的 DNA 转录而来的信使RNA(mRNA)的片段分子或microRNA (miRNA)。由于RNA和其他分子的水平提供了有关源自健康和患病器官的细胞状态的广泛信息,因此EV成为了可用于诊断疾病的丰富、易于获取的分子信息来源。
“这个新兴领域的主要挑战是缺乏关于如何将EV与生物流体分离的标准。EV的丰度非常低,实际上远低于也在血液中循环的类似大小的蛋白质聚集体和脂蛋白,并且通常会被共同分离,这意味着EV不容易被纯化。”共同第一作者Dima Ter-Ovanesyan博士和Maia Norman博士说。“按照制定有效策略获取EV的要求,我们首先需要有一种灵敏的方法来定量测量这些颗粒。”
“为了能够测量EV,我们开发了一种称为Simoa检测的高灵敏度检测方法,该检测方法可检测三种生物分子,被称为四次跨膜蛋白tetraspanins,它们在大多数EV表面可变存在。此外,我们还建立了一种Simoa测定法来测量白蛋白,白蛋白是EV制剂的主要游离蛋白质污染物,这会损害EV作为分子信息来源的有用性。”Norman博士说。
在之前的一项研究中,该团队使用相同类型的测定法排除了一种广泛使用的候选表面蛋白 L1CAM,这是一种分离脑特异性EV的靶点,这导致需要重新考虑一系列大脑诊断方法的有效性。
Simoa技术是常用ELISA检测的数字化版本,研究人员使用特定抗体分子捕获感兴趣的蛋白质,该抗体分子与比抗体本身大得多的磁珠相连。与蛋白质一起,整个EV被抗体拾取。然后用产生荧光信号的第二抗体检测结合的蛋白质(和相关的EV)。因此,通过将四次跨膜蛋白与两种抗体“夹在”多孔板的单个孔中,每个孔只能容纳一个磁珠,Simoa 能够在单分子水平上对捕获的EV进行数字计数,这远远超过了灵敏度传统的ELISA检测方法。
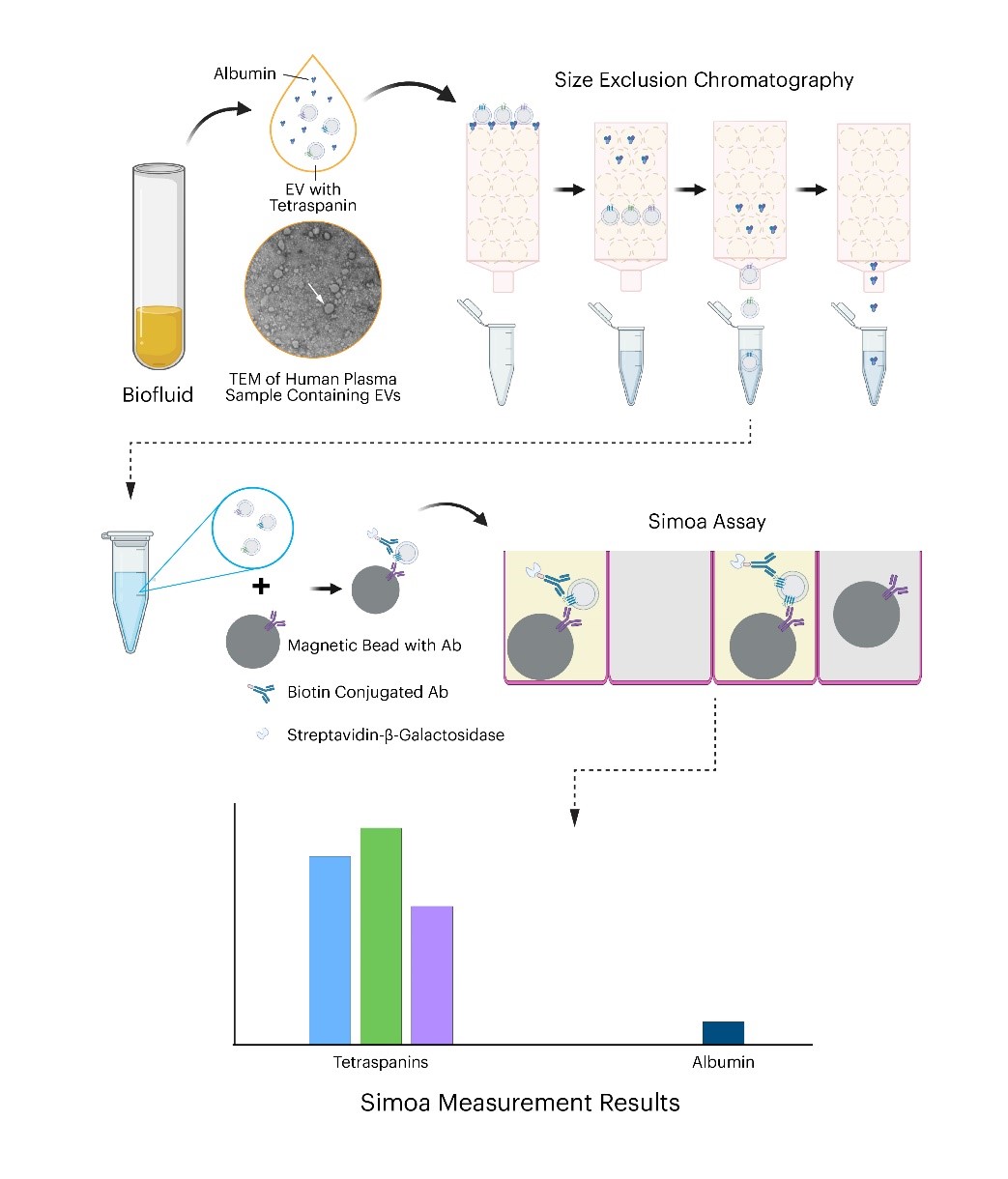
研究人员开发了对三种四次跨膜蛋白CD9、CD63和CD81以及白蛋白的Simoa分析,作为捕获的EV及其纯度的可靠读数,研究人员确定了一种从脑脊液 (CSF) 中分离EV的有效方法。
“我们比较了不同的分离方法,这些方法要么涉及高速离心(超速离心)沉淀EV,要么用化学法沉淀它们,要么使用称为尺寸排阻色谱法 (SEC) 的生化方法根据它们的大小将它们与其他分子结构分离。通过使用我们的Simoa 测定法测量获得的EV的纯度和产量,”Ter-Ovanesyan说,“事实证明,SEC是从CSF和血浆中纯化EV的最有效方法。”
在SEC中,树脂的多孔珠子被填充到柱子中,在柱子中它们充当反分子筛,因为它们的孔充当隧道状开口,仅允许低于一定尺寸的分子和结构进入。结果是,这些小结构通过柱子的速度会减慢,而不能进入珠子的较大结构很容易通过它们之间的空间,并更快地通过柱子。
“在使用了市售的SEC色谱柱后,我们决定通过定制我们自己的具有不同树脂和长度的SEC 色谱柱来深入挖掘。这提供了一个组合路线,使我们能够在高纯度但低于最大纯度的情况下获得最大产量,或者在产量略微降低的情况下获得最大纯度的EV。”Norman 解释说。
“这项分析使我们能够从各种疾病的患者中识别出EV。在未来的液体活检工作中,我们的目标是开发额外的检测方法来区分来自大脑的EV,并将在其中寻找与疾病相关的生物标志物特征。”Walt 说。




