瘤内异质性驱动癌症进展和治疗抵抗。然而,尚未确定癌细胞亚群是否以及如何相互作用以及这种相互作用如何影响肿瘤。近日,来自葡萄牙的研究人员在Gut杂志(IF=23.059)上发表文章,报道了来自胰腺导管腺癌(PDAC)细胞亚群的EV构建了一个有组织的通信网络;胰腺癌干细胞的细胞外囊泡主导这个肿瘤内通信网络(EVNet),它赋予肿瘤可塑性并支持肿瘤进展;从癌症干细胞(CSC)到非干性癌细胞的通讯激活PDAC肿瘤中的YAP并推动疾病进展;通过靶向EVNet和CSC EVs会抑制PDAC肿瘤生长。
肿瘤内异质性被认为是胰腺导管腺癌(PDAC)进展和治疗抵抗的主要驱动因素之一。基因组、非基因组和功能性细胞状态异质性导致不同的癌细胞行为,是癌症治疗的主要障碍之一。PDAC异质性的证据表明,不同细胞表面分子的存在定义了具有不同致瘤能力的癌细胞亚群。特别是,胰腺癌干细胞(CSC)的特点是表达特定的表面标志物,并且与PDAC的不良预后相关。CD24、CD44、CD133和EpCAM可识别胰腺癌中具有不同致瘤能力的亚群。据推测,癌细胞亚群之间的合作对于维持异质性和增强肿瘤促进功能至关重要。然而,这种合作如何发生仍然难以不清楚。细胞外囊泡(EVs)是细胞间通讯的中心介质。EV由所有细胞类型分泌,存在于所有体液中。EVs利用它们的基因和分子货物来重新编程受体细胞。特别是,癌症EV可促进癌症相关成纤维细胞(CAF)的分化、增强血管生成、调节抗肿瘤免疫反应、建立转移前生态位并赋予非转移性癌细胞转移特性。然而,具有不同表型和肿瘤形成能力的癌细胞亚群之间的EV交换尚未得到解析。该研究首次揭示了由CSC EV介导的有组织的通信网络,并展示了其在肿瘤生物学中的重要性;揭示了这种交流是肿瘤内合作的基本过程,并有助于其可塑性和对治疗的抵抗力。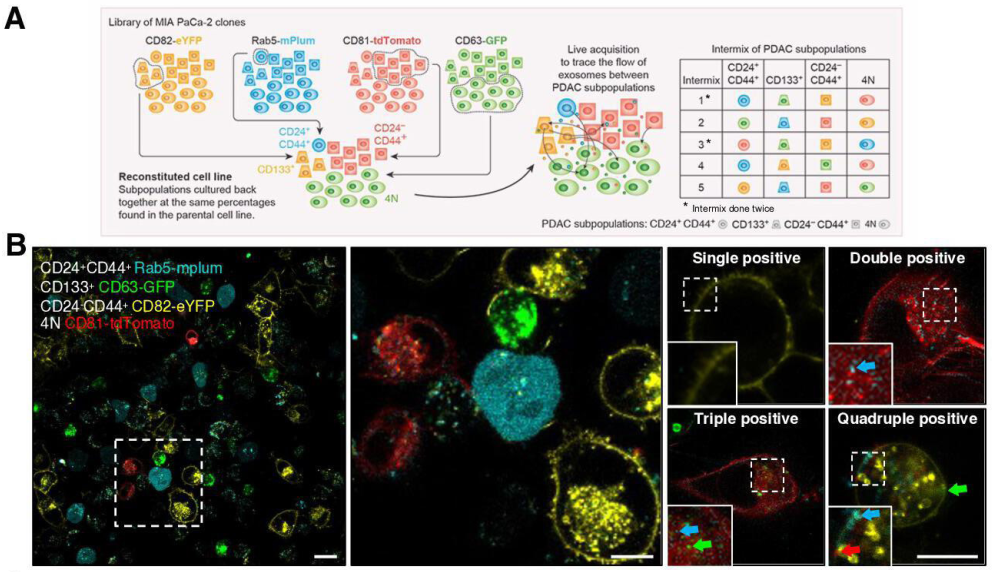
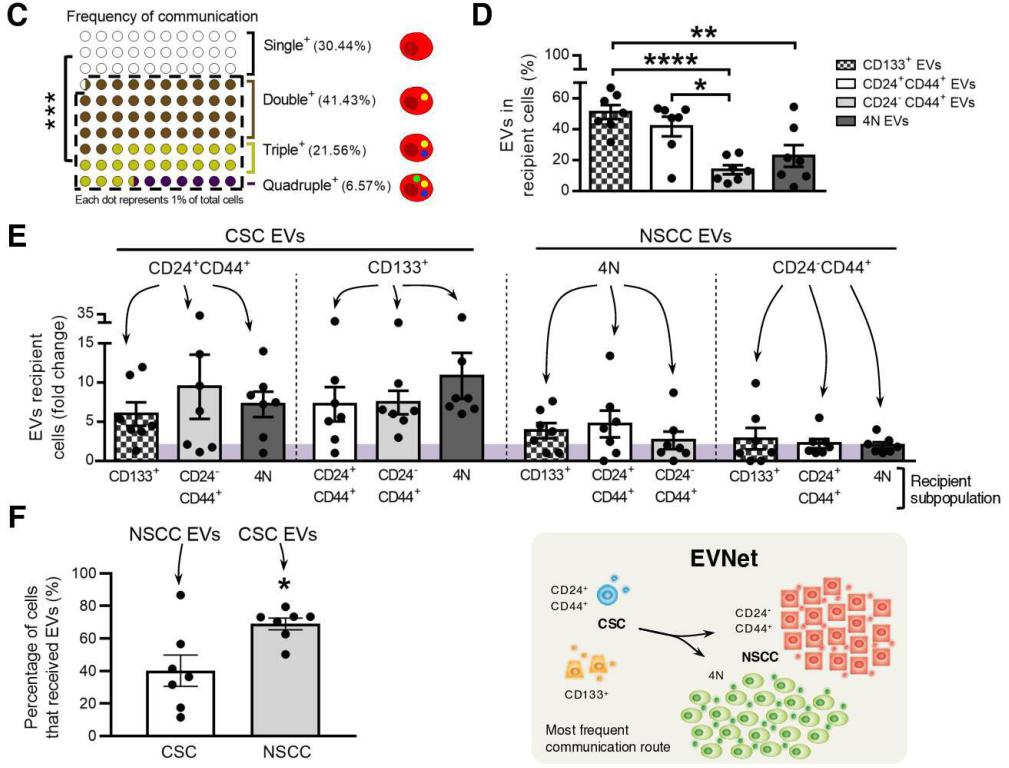
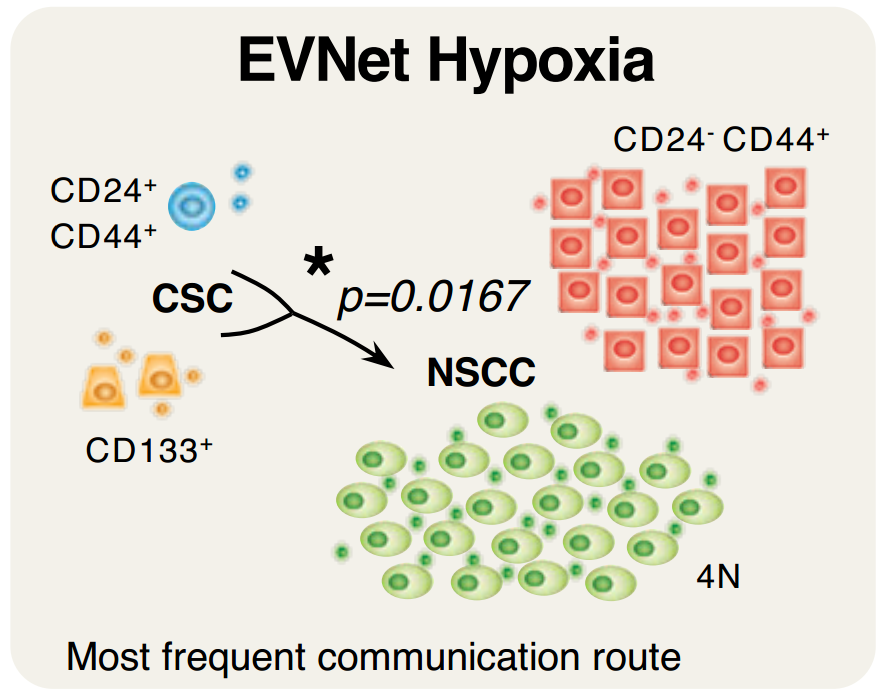
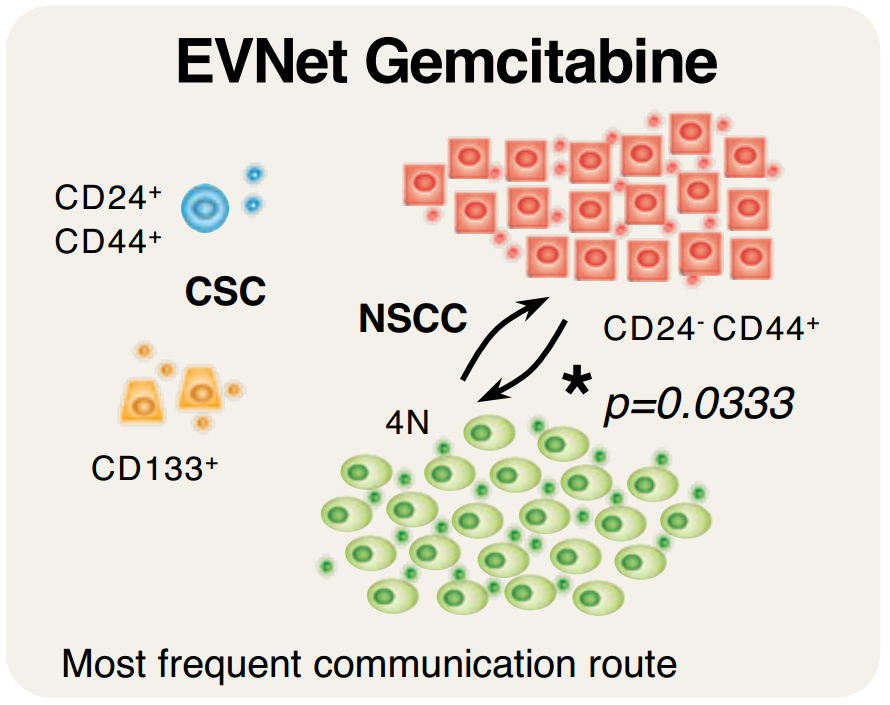
PDAC EVNet中最频繁的通信路径是从CSC到NSCC该报道研究了细胞外囊泡(EV)在癌细胞亚群之间的自发流动:癌症干细胞(CSC)和非干性癌细胞(NSCC)。为了确定最常见的交流途径的生物学意义,使用胰腺导管腺癌(PDAC)原位模型、患者来源的异种移植物(PDX)和基因工程小鼠模型(GEMM)。研究证明PDAC肿瘤使用称为EVNet的EV在癌细胞亚群之间建立了一个有组织的通信网络。EVNet是可塑的,可以根据环境进行重塑。EVNet内的通信优先从CSC到NSCC。通过在原位异种移植片、GEMMs和PDXs中损害Rab27a功能来抑制这种通讯途径足以阻碍肿瘤生长,并在整个肿瘤中表现出抑制通讯的作用。机制上,该研究提供的证据表明,CSC EV使用集聚蛋白(agrin)通过LDL受体相关蛋白4(LRP-4)促进Yes1相关转录调节因子(YAP)的激活。用抗agrin对PDXs进行离体处理会显著损害增殖并降低活化YAP的水平。具有高水平agrin和低非激活YAP的患者表现出更差的无病生存率。此外,循环agrin+ EV数量较多的患者疾病进展风险显著增加。PDAC肿瘤建立了一个由CSC和agrin参与的EV介导的合作网络,使肿瘤能够适应和增殖。靶向agrin可以使PDAC患者的靶向治疗成为可能,并对CSC产生重大影响,CSC是肿瘤的营养物质,是治疗抵抗的中心。在缺氧条件下,癌细胞亚群之间建立的通信网络的相应图形表示。与EVNet中的同一路径相比,从CSC到NSCC最频繁的通信路径非常重要在吉西他滨治疗下癌细胞亚群之间建立的通信网络的各自图形表示。与EVNet中的相同路径相比,NSCC的两个亚群之间出现最频繁的通信路径- 肿瘤内异质性是胰腺导管腺癌(PDAC)肿瘤的一个特征,导致其预后不佳。
- 已经假设癌细胞亚群之间的合作可以促进疾病进展和治疗抵抗。
- 癌细胞通过EV与肿瘤微环境和远处器官的细胞进行交流,以支持肿瘤进展。
- 来自PDAC细胞亚群的EV建立了一个有组织的通信网络,来自胰腺癌干细胞的细胞外囊泡领导一个肿瘤内通信网络(EVNet),它赋予肿瘤可塑性并支持肿瘤进展。
- 从癌症干细胞(CSC)到非干性癌细胞的通讯激活PDAC肿瘤中的YAP并推动疾病进展。从机制上讲,CSC EV中的agrin通过LRP-4受体激活PDAC肿瘤中的YAP。
- 通过抑制Rab27a或集聚蛋白靶向EVNet和CSC EV会损害PDAC肿瘤生长。
- 循环agrin阳性EV是确定治疗反应和PDAC进展风险的潜在生物标志物。
- 抗凝集素治疗可以靶向CSC,因此显著影响肿瘤进展和治疗抵抗,从而为PDAC患者提供靶向治疗的可能性。
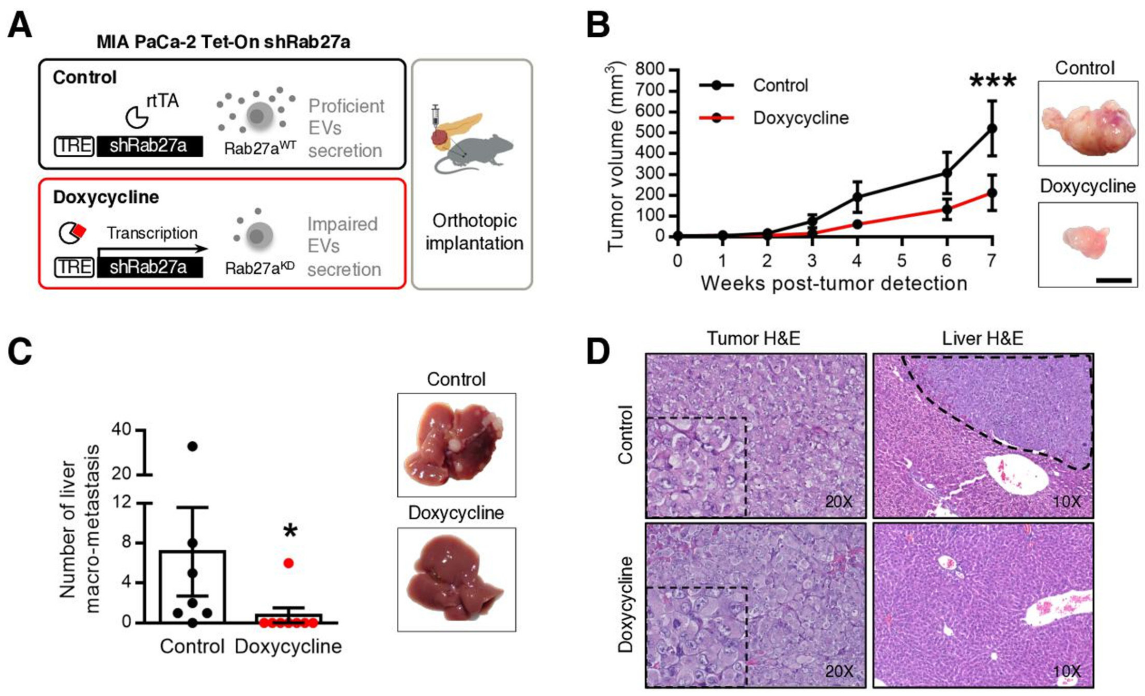
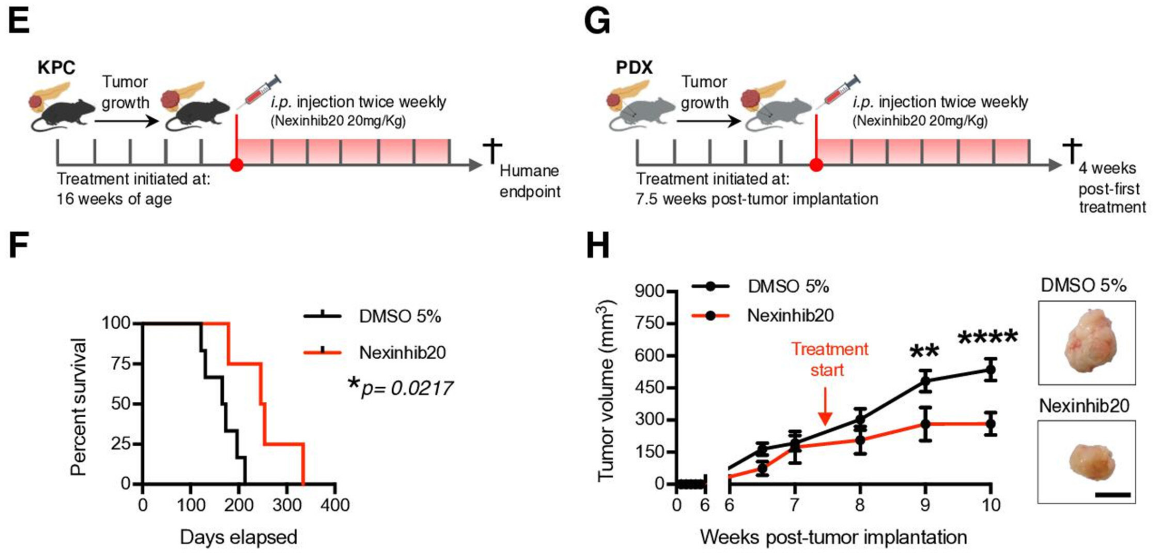
EVnet的损伤阻碍了PDAC原位、GEMM和PDX模型中的肿瘤生长RuivoCF, Bastos N, Adem B, Batista I, Duraes C, Melo CA, Castaldo SA, Campos-LaborieF, Moutinho-Ribeiro P, Morão B, Costa-Pinto A, Silva S, Osorio H, Ciordia S,Costa JL, Goodrich D, Cavadas B, Pereira L, Kouzarides T, Macedo G, Maio R,Carneiro F, Cravo M, Kalluri R, Machado JC, Melo SA. Extracellular Vesiclesfrom Pancreatic Cancer Stem Cells Lead an Intratumor Communication Network(EVNet) to fuel tumour progression. Gut. 2022 Jan10:gutjnl-2021-324994. doi: 10.1136/gutjnl-2021-324994. Epub ahead of print.PMID: 35012996.外泌体资讯网 Gut:胰腺癌干细胞的细胞外囊泡主导瘤内通讯网络促进肿瘤进展