外泌体/小细胞外囊泡(sEV) 可以通过其miRNA 和蛋白质货物作为细胞间通讯的介质。来自哈佛医学院的研究人员在CellReports杂志发表文章,对参与代谢疾病的一些细胞系的sEV蛋白质组进行比较,识别出一系列独特sEV标志物,并证明这些标志物可以帮助预测血清 sEV的起源组织。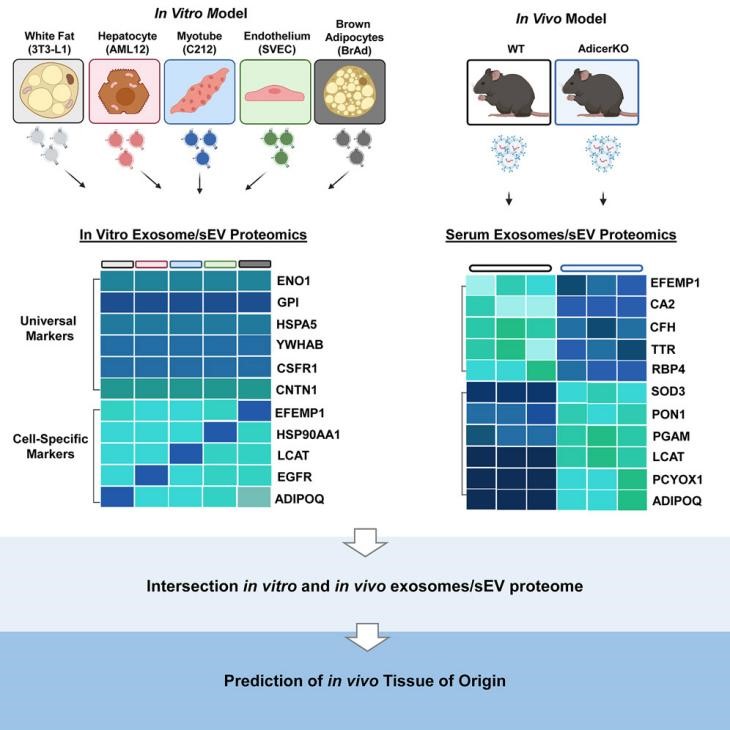
结论1:不同的细胞类型的外泌体/sEV具有独特的蛋白释放模式
结论2:传统的sEV 标志物(如一些四次跨膜蛋白)在不同细胞类型的sEV中的丰度不同
结论3:体外sEV 蛋白质组可用于预测体内循环sEV的组织来源
结论4:脂联素是一种脂肪组织特异性sEV 标志物
外泌体和其他小细胞外囊泡 (sEV) 已成为细胞间通讯和代谢调节的重要介质。sEV包含的分子范围广泛,包括蛋白质、编码和非编码RNA的不同亚类、DNA和代谢物。sEVs 存在于生物体的每一种体液中,包括血浆/血清、尿液和脑脊液。由于sEV货物受生理和病理状态的影响,可用作诊断和预测多种疾病预后的标志物,包括糖尿病、肥胖症、癌症以及心血管和神经退行性疾病。例如,肥胖患者循环中的sEV 的perilipin 水平增加,而来自阿尔茨海默病患者的sEV 则具有更高水平的β-淀粉样蛋白和磷酸化tau 蛋白。在胶质母细胞瘤或前列腺癌患者的血清sEV 中,还发现肿瘤标志物如表皮生长因子受体变体III (EGFRvIII) 和前列腺特异性抗原的增加。虽然过去十年的研究已经清楚地确定sEV中的micro RNA (miRNA) 货物是受调节的并且依赖于细胞类型,但很少有人关注蛋白质分类到sEV中在不同细胞类型之间的差异。在本研究中,研究人员使用定量蛋白质组学来比较从不同细胞系中分离出的sEV 的蛋白质货物,这些细胞系代表参与代谢疾病的主要组织,包括白色和棕色脂肪细胞、肌肉细胞、肝细胞和内皮细胞、以及分化的小鼠基质血管组分(SVF) 衍生的脂肪细胞。研究表明,每种细胞类型都有一个独特的sEV蛋白质组。虽然CD9/CD63/CD81等经典sEV 标志物的丰度差异很大,但有六种sEV 标志物(ENO1、GPI、HSPA5、YWHAB、CSF1R 和 CNTN1)在所有细胞类型的sEV中丰富,即:烯醇化酶 (ENO1) 、葡萄糖-6-磷酸异构酶(GPI),伴侣蛋白HSPA5(也称为如 BiP)、14-3-3 蛋白β/α (YWHAB)、集落刺激因子受体(CSF1R) 和GPI锚定接触蛋白1(CNTN1)。每种细胞类型的sEV 都含有代表特定细胞类型标记的独特蛋白质分布。使用这个数据集,研究人员还可以预测血清样本中一些sEV 蛋白的来源组织。将来自正常小鼠的sEV 与具有脂肪组织特异性 Dicer 敲除 (AdicerKO) 的小鼠进行比较,敲除小鼠出现了棕色脂肪组织 (BAT) 扩大和白色脂肪组织 (WAT)减少。研究人员发现两组小鼠血清中25%的蛋白质存在显著改变,其中包括几个标记为白色或棕色脂肪细胞来源的sEV,例如高分子量脂联素(ADIPOQ),它位于sEV 膜的表面,可以与目标受体细胞结合。这些数据证明了不同细胞类型的sEV 中蛋白质的独特性质,以及这些蛋白质的水平如何用作识别起源组织的生物标志物。研究人员对本研究也提出了一些不足和限制,例如,对于培养中的细胞,尽管超速离心与SEC的纯化步骤获得了纯度相似的外泌体/sEV 分离物,但不能排除血清中丰富的循环蛋白和脂蛋白在提取的sEV中完全不存在。第二,从小鼠 中获得的血清量 (350–400 μL)相对较少,加上每个纯化步骤中 sEV 的损失,限制了组合分离技术在小鼠研究中的应用。第三,ADIPOQ 存在于白色脂肪细胞衍生的外泌体/sEV 的表面上,虽然ADIPOQ 的主要来源是脂肪组织,但正如多项研究使用ADIPOQ 启动子来驱动基因在脂肪细胞中的特异性表达,研究人员不能排除一些循环ADIPOQ 从血清吸附到源自其他细胞类型的sEV表面的可能性。当然,与在白色脂肪细胞衍生的sEV中直接释放ADIPOQ相比,前者的可能非常小。 参考文献:Tissue differences in theexosomal/small extracellular vesicle proteome and their potential as indicatorsof altered tissue metabolism. Cell Rep. 2022 Jan 18;38(3):110277.
外泌体资讯网 Cell Rep:外泌体蛋白质组的组织间差异性并作为组织代谢标志物





