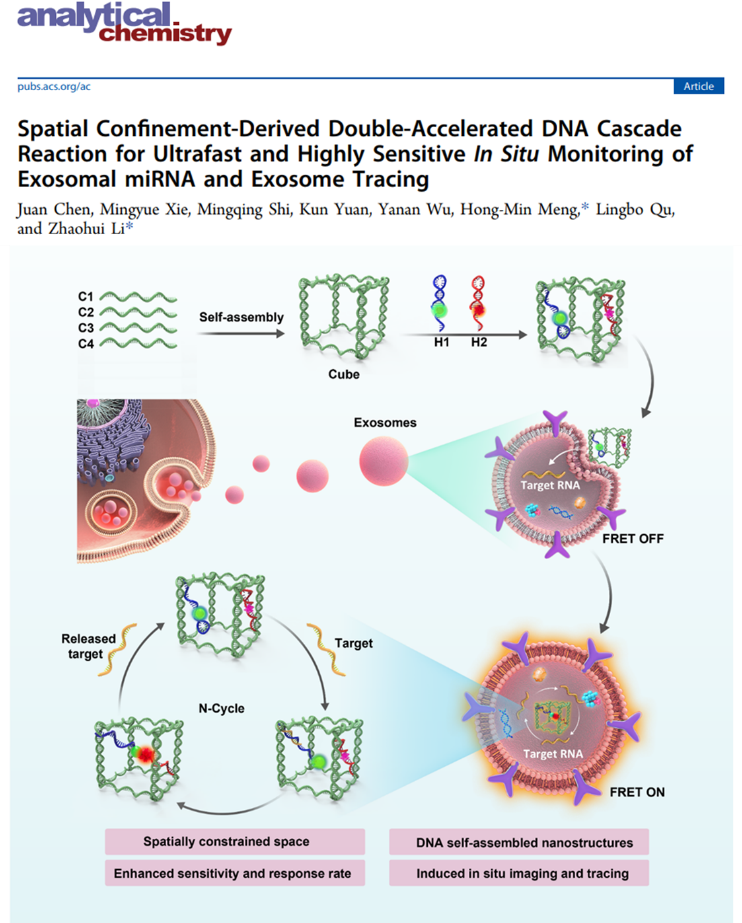
外泌体是一种纳米级细胞外囊泡,研究表明,其在多种生理和病理过程中发挥着至关重要的作用,生物体通过转移外泌体携带的物质来调节细胞间通讯。外泌体包含多种来自亲本细胞的特定生物活性物质,如RNA、DNA、脂类和蛋白质等。其中RNA特别是外泌体包裹的miRNA,在血液循环中具有良好的稳定性,有望作为诊断疾病进展的生物标志物。然而,由于其丰度低、磷脂双层结构的渗透性差,原位检测外泌体miRNA仍是一个挑战。
近日,郑州大学化学学院李朝辉、孟红敏团队开发了一种简单、快速和高生物学稳定性的DNA放大器用于循环肿瘤外泌体miRNA-21特异性成像及外泌体示踪,相关成果以“Spatial Confinement-Derived Double-Accelerated DNA Cascade Reactionfor Ultrafast and Highly Sensitive In Situ Monitoring of Exosomal miRNA andExosome Tracing”为题发表在Anal. Chem (2022 Jan 14. doi: 10.1021/acs.analchem.1c04916)上。该团队开发的基于比率型的双重局部加速的DNA级联反应器,不仅可以超快速实现外泌体内miRNA的信号放大检测及精准的原位成像,还可以实现外泌体在活细胞内的示踪,显示其在临床诊断中的应用潜力。
该团队首先开发了一种同时修饰有Cy3和Cy5的双加速DNA级联放大器(称为DDCA)。将其与外泌体孵育后,由于DDCA的刚性结构,其可以快速进入外泌体,并与目标miRNA发生一系列链置换反应,产生FRET的比率荧光信号。同时,释放的miRNA参与新的催化循环,导致产生放大的荧光信号。另外,由于DNA纳米立方体结构的空间限域效应,大大提高了外泌体miRNA的检测速度。
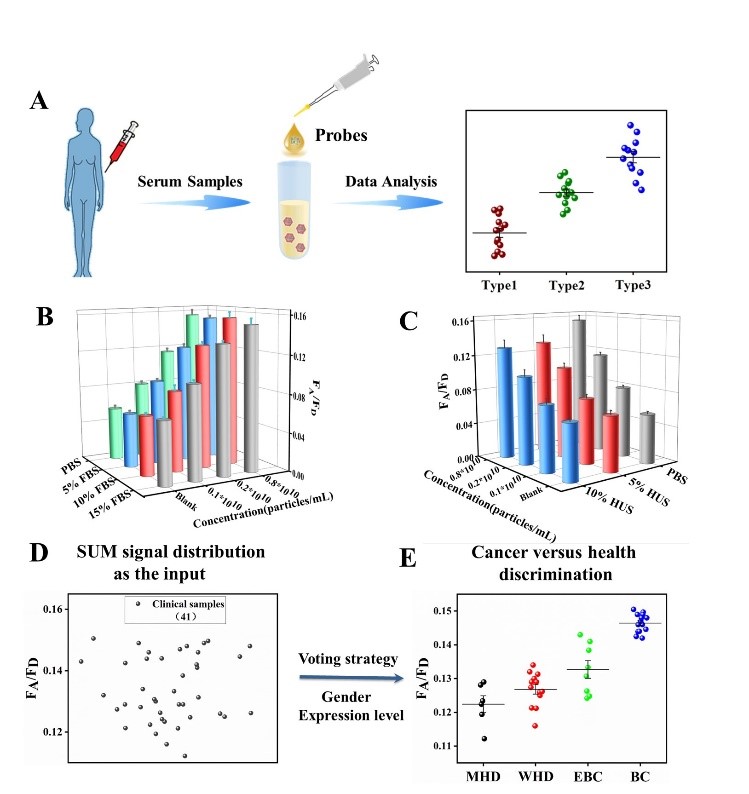
此外,研究人员对该方法在临床复杂样品中的潜在应用价值进行了考察,从41例血清样本的统计学数据可以看出,该方法通过检测血清样品中外泌体miRNA-21的FRET信号可实现不同肿瘤的区分,与临床诊断结果一致,显示其在癌症早期快速筛查及疾病进展方面的临床应用潜力。同时,进一步将DDCA标记的外泌体与Hoechst 33342染色的MCF-7细胞进行孵育,通过观察MCF-7细胞的3D图像,发现MCF-7细胞中具有明显的FRET信号,该策略为可视化示踪外泌体在细胞间的通讯提供了一种新的分子工具。
参考文献:
Spatial Confinement-DerivedDouble-Accelerated DNA Cascade Reaction for Ultrafast and Highly Sensitive InSitu Monitoring of Exosomal miRNA and Exosome Tracing, Anal. Chem doi.org/10.1021/acs.analchem.1c04916
外泌体资讯网 Analytical Chemistry| 郑州大学李朝辉、孟红敏团队:外泌体miRNA的超快速高灵敏原位检测及外泌体示踪新方法