化疗耐药、转移和免疫逃逸是卵巢癌当前临床治疗的主要问题。越来越多的研究表明,细胞外囊泡(Extracellular vesicles, EVs) 在卵巢癌的进展、转移和耐药性中起重要作用。同时,EV也成为预测和监测卵巢癌药物治疗效果的候选生物标志物来源之一,同时也是潜在的治疗靶点或载体可用于逆转卵巢癌化疗耐药性。
近日,郑州大学第一附属医院常蕾副教授联合澳大利亚新南威尔士大学Yong Li教授在生物科学1区杂志Cell Death & Disease杂志上以“Extracellular vesicles in ovarian cancer chemoresistance,metastasis, and immune evasion”为题发表论文(2022,18;13(1):64),总结了细胞外囊泡在卵巢癌化疗耐药、转移和免疫逃逸机制方面的研究进展,并讨论了当前研究中的挑战,及EVs作为很有前途的生物标志物在卵巢癌患治疗中的临床转化前景。郑州大学第一附属医院常蕾副教授和澳大利亚新南威尔士大学Yong Li教授作为论文共同通讯作者,硕士研究生田万家及郑州大学基础医学院雷宁静博士作为论文共同第一作者。
手术联合化疗是卵巢癌的一线治疗方案,但患者逐渐产生化疗耐药,严重影响其预后。该文介绍了EVs在卵巢癌中的生物学效应及其对耐药性的影响。作者将EVs与化疗耐药之间的影响总结为四个方面:1. 卵巢癌细胞通过分泌EVs直接排出药物分子;2. EVs通过转运耐药相关的ncRNA参与化疗耐药的发展;3. EVs通过转运活性蛋白来改变靶细胞对化疗药物的敏感性;4. EVs通过调节肿瘤微环境来影响卵巢癌细胞的化疗耐药性。同时,作者也列表总结了近期发表文献中,EVs携带的miRNA在卵巢癌化疗耐药中的作用及其机制。
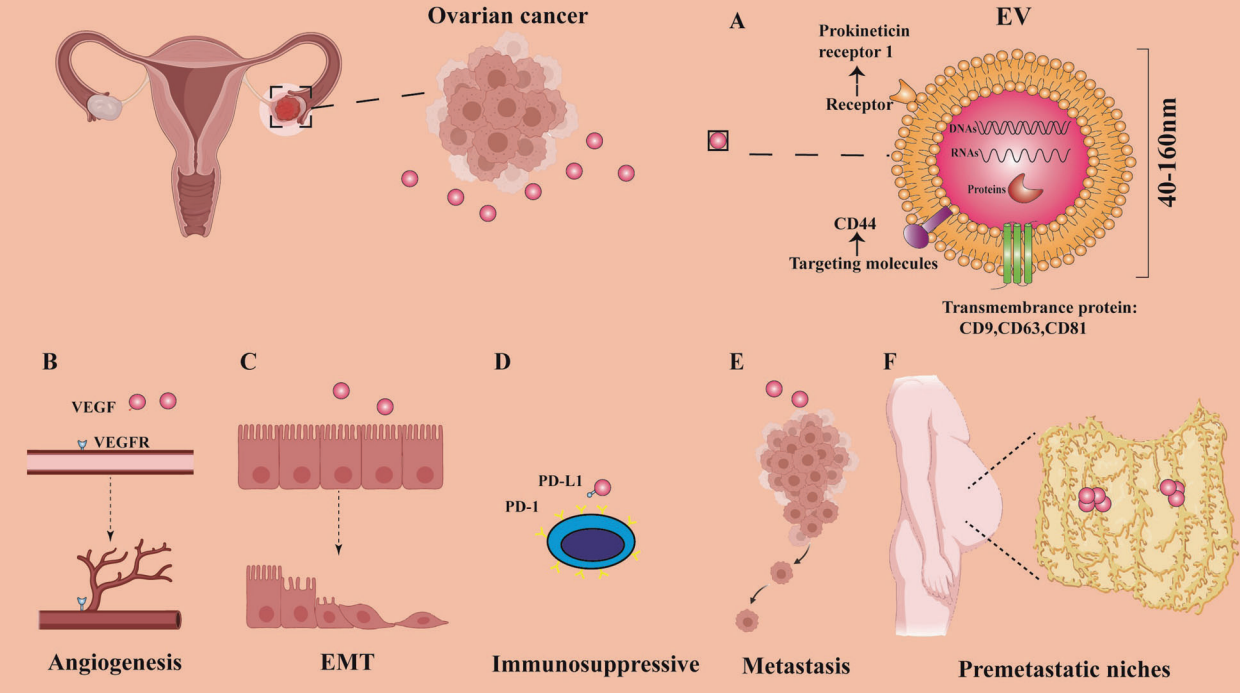
卵巢癌治疗及预后的另一大难题是腹腔转移,而EVs在肿瘤转移中的作用已得到广泛的认可。该文作者对EVs在刺激血管生成,促进细胞外基质重塑,建立转移前的生态位,抑制免疫反应,直接促进肿瘤转移等方面的作用进行了总结和讨论。
图1. EVs 在卵巢癌转移中的作用
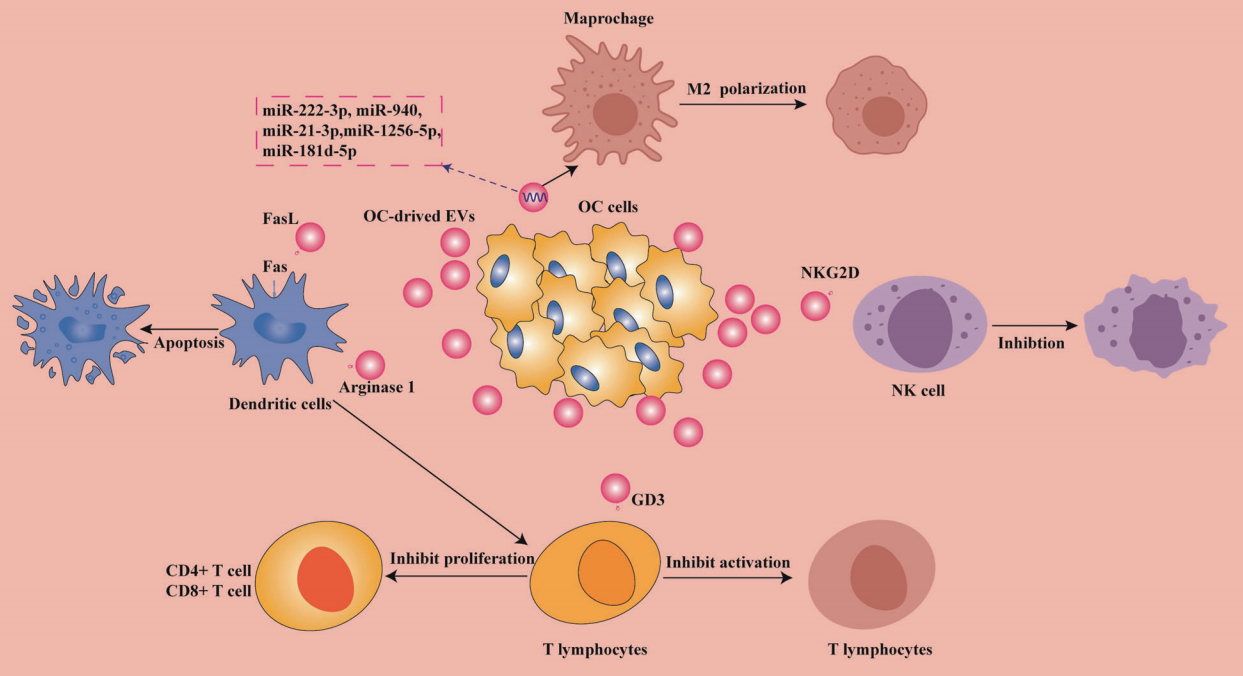
由于卵巢癌的病理亚型十分复杂,卵巢癌的免疫治疗干预机制很大程度上存在未知。虽然目前Avastin (bevacizumab)已被美国食品和药物管理局(theFood and Drug Administration, FDA)批准用于治疗某些晚期卵巢癌患者,然而由于卵巢癌通常具有有限的免疫细胞浸润或广泛的免疫抑制T细胞浸润的特征,使其成为一种低免疫反应性癌症,其治疗结果并不能令人满意。EVs被发现以多种方式参与卵巢癌的免疫逃逸过程,包括通过调节免疫细胞的功能及影响先天和适应性免疫反应。在下图中,作者展示了EVs在调节肿瘤免疫逃逸中的潜在作用。
图2. EVs 在卵巢癌免疫逃逸中的作用
参考文献:
Extracellular vesicles in ovariancancer chemoresistance, metastasis, and immune evasion. Cell death & disease. 2022;13(1):64.
常蕾,博士,副主任医师、副教授、研究生导师。研究方向:妇科肿瘤放化疗耐受研究。近五年先后在SCI期刊发表学术论文30余篇,在国际著名学术期刊以第一、通讯作者发表论文近20余篇,2020年获得国家高层次回国人员资助,主持完成国家自然科学基金、国家博士后基金等多项科研项目,获得第十四届河南省青年科技奖。先后荣获河南省杰出青年、河南省“中原人才”青年拔尖人才、河南省高校创新人才等荣誉。
外泌体资讯网 Cell Death Disease郑大一附院常蕾/新南威尔士Yong Li :细胞外囊泡在卵巢癌耐药、转移和免疫逃逸中的作用