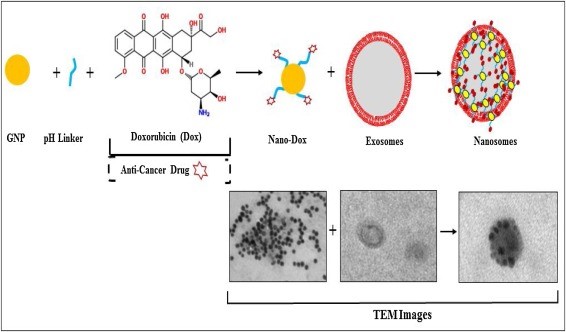
外泌体通过携带来自供体或亲本细胞的一些物质并将它们递送至受体细胞来进行细胞间通讯,其独特的装载能力被用作抗癌药物和显像剂的运载工具。来自美国俄克拉荷马大学的研究人员在Seminars in Cancer Biology上发表综述文章,探讨了分离外泌体用作癌症治疗药物载体的各种来源,讨论了外泌体的分离方法以及装载癌症治疗剂和显像剂的过程,总结了基于外泌体的癌症诊断和治疗应用的未来方向。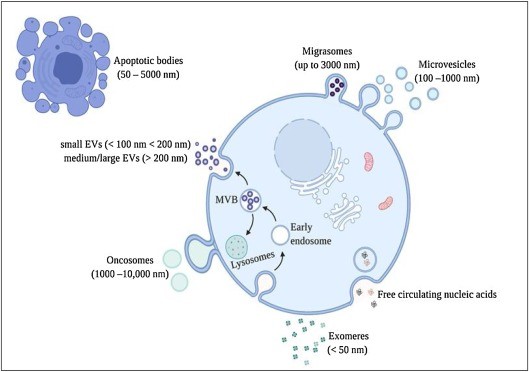 化学治疗方案的成功与否很大程度上取决于能否将治疗剂有效且精确地递送至癌细胞,而对健康细胞无副作用或细胞毒性最小化。多年来,纳米医学研究人员一直致力于开发多种合成纳米材料,可以作为药物载体并以靶向方式向癌细胞提供抗癌治疗。尽管在这方面取得了重大进展,但很少有药物载体进入临床。较差的生物相容性、低效的生物分布和非预期的免疫原性反应是许多合成药物递送复合物失败的原因。脂质体是使用各种磷脂和胆固醇组合物配制而成,是迄今为止开发和测试用于癌症治疗的最成功的药物递送系统。然而由于其合成性质,脂质体较差的靶向性、细胞因子风暴和免疫反应的产生、形态不稳定性以及它们无法通过许多严格的生物屏障,仍然限制了临床应用。作为合成脂质体的替代品,由植物、微生物或人体自身细胞产生的“天然纳米颗粒”,如细胞外囊泡 (EV),正在作为抗癌药物的载体进行研究。每种类型的 EV 在细胞中都具有功能性作用,并具有不同的生理过程。外泌体是最大的 EV 亚型,经典定义为纳米尺寸(30-150nm)的脂质双层囊泡,由所有类型的细胞通过内体途径产生。2018 年,国际细胞外囊泡协会建议,在没有外泌体特异性标记的情况下避免使用外泌体一词,而是建议以尺寸为基础描述(小型EV < 100 nm 或 <200 nm;中/大型EV> 200 nm)。在合成过程中,外泌体与由不同生物活性分子组成的货物包装在一起,如脂质、蛋白质、DNA、RNA。外泌体的表面嵌入了融合蛋白,这些融合蛋白参与靶向和与受体细胞表面的附着。外泌体中最丰富的蛋白质是四次跨膜蛋白(如CD63、CD81 和 CD9)和靶向蛋白(如整合素)。外泌体膜也富含脂质,包括胆固醇、鞘磷脂、神经酰胺、溶血(双)磷脂酸、溶血磷脂酰胆碱、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰肌醇、磷脂酸和磷脂酰甘油。 外泌体的含量很重要,因为它反映了其来源细胞的组成和生理状态。由于外泌体存在于包括尿液、血浆/血清和脑脊液在内的所有体液中,因此被用于研究疾病的病理生物学并开发新的液体活检方式疾病的诊断,包括癌症。在这篇综述里,研究人员旨在讨论从多种天然来源分离的外泌体,或称之为“机体外泌体(organic exosome)”在癌症治疗和诊断领域的潜力。 首先,研究人员讨论了外泌体在癌症诊断和治疗中的开发和使用。通过比较来自多项研究的数据,提出了外泌体作为合成脂质体作为药物载体或递送载体的潜在替代品的前提。外泌体是天然产生的囊泡,因此比合成运载工具具有许多优势;这是使用外泌体作为药物输送载体或载体的核心理念。器官倾向性、非免疫原性、受体细胞的有效摄取以及在同一囊泡中同时包装多个有效货物是外泌体的一些示例性特性,这些特性使其适合用作药物递送载体。然而,研究人员认为,在将基于外泌体的递送系统转化为临床,并取代现有的成功的基于脂质体方式之前,必须克服重要的挑战。需要解决:探索用于大规模纯化同质外泌体群的有效分离方法,鉴定和显示最大治疗装载和运输效率的特定外泌体群。由于外泌体科学是一个相对较新的研究领域,因此有必要加强我们对外泌体合成的生物发生和基本生理学的理解,以开发装载感兴趣分子的过程。最后,必须解决用于大规模分离外泌体的起始材料的选择。外泌体使其成为理想的药物输送载体的特性也支持它们用作癌症治疗学。外泌体科学界最近开始探索许多已描述的用于外泌体分离的生物来源,并从中开发药物递送载体和治疗学。“机体外泌体”的想法尚处于起步阶段,但仍然是一个有吸引力的研究领域,以开发具有临床相关性的产品。虽然还有几个里程碑尚未实现,但在EV领域取得了巨大进步,外泌体在癌症治疗、诊断和临床治疗中的成功应用并不遥远。图2:外泌体和携带阿霉素的金纳米颗粒合成的混合递送系统参考文献:Organically derived exosomes as carriers ofanticancer drugs and imaging agents for cancer treatment. Semin Cancer Biol.2022 Feb 19:S1044-579X(22)00047-5.
化学治疗方案的成功与否很大程度上取决于能否将治疗剂有效且精确地递送至癌细胞,而对健康细胞无副作用或细胞毒性最小化。多年来,纳米医学研究人员一直致力于开发多种合成纳米材料,可以作为药物载体并以靶向方式向癌细胞提供抗癌治疗。尽管在这方面取得了重大进展,但很少有药物载体进入临床。较差的生物相容性、低效的生物分布和非预期的免疫原性反应是许多合成药物递送复合物失败的原因。脂质体是使用各种磷脂和胆固醇组合物配制而成,是迄今为止开发和测试用于癌症治疗的最成功的药物递送系统。然而由于其合成性质,脂质体较差的靶向性、细胞因子风暴和免疫反应的产生、形态不稳定性以及它们无法通过许多严格的生物屏障,仍然限制了临床应用。作为合成脂质体的替代品,由植物、微生物或人体自身细胞产生的“天然纳米颗粒”,如细胞外囊泡 (EV),正在作为抗癌药物的载体进行研究。每种类型的 EV 在细胞中都具有功能性作用,并具有不同的生理过程。外泌体是最大的 EV 亚型,经典定义为纳米尺寸(30-150nm)的脂质双层囊泡,由所有类型的细胞通过内体途径产生。2018 年,国际细胞外囊泡协会建议,在没有外泌体特异性标记的情况下避免使用外泌体一词,而是建议以尺寸为基础描述(小型EV < 100 nm 或 <200 nm;中/大型EV> 200 nm)。在合成过程中,外泌体与由不同生物活性分子组成的货物包装在一起,如脂质、蛋白质、DNA、RNA。外泌体的表面嵌入了融合蛋白,这些融合蛋白参与靶向和与受体细胞表面的附着。外泌体中最丰富的蛋白质是四次跨膜蛋白(如CD63、CD81 和 CD9)和靶向蛋白(如整合素)。外泌体膜也富含脂质,包括胆固醇、鞘磷脂、神经酰胺、溶血(双)磷脂酸、溶血磷脂酰胆碱、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰肌醇、磷脂酸和磷脂酰甘油。 外泌体的含量很重要,因为它反映了其来源细胞的组成和生理状态。由于外泌体存在于包括尿液、血浆/血清和脑脊液在内的所有体液中,因此被用于研究疾病的病理生物学并开发新的液体活检方式疾病的诊断,包括癌症。在这篇综述里,研究人员旨在讨论从多种天然来源分离的外泌体,或称之为“机体外泌体(organic exosome)”在癌症治疗和诊断领域的潜力。 首先,研究人员讨论了外泌体在癌症诊断和治疗中的开发和使用。通过比较来自多项研究的数据,提出了外泌体作为合成脂质体作为药物载体或递送载体的潜在替代品的前提。外泌体是天然产生的囊泡,因此比合成运载工具具有许多优势;这是使用外泌体作为药物输送载体或载体的核心理念。器官倾向性、非免疫原性、受体细胞的有效摄取以及在同一囊泡中同时包装多个有效货物是外泌体的一些示例性特性,这些特性使其适合用作药物递送载体。然而,研究人员认为,在将基于外泌体的递送系统转化为临床,并取代现有的成功的基于脂质体方式之前,必须克服重要的挑战。需要解决:探索用于大规模纯化同质外泌体群的有效分离方法,鉴定和显示最大治疗装载和运输效率的特定外泌体群。由于外泌体科学是一个相对较新的研究领域,因此有必要加强我们对外泌体合成的生物发生和基本生理学的理解,以开发装载感兴趣分子的过程。最后,必须解决用于大规模分离外泌体的起始材料的选择。外泌体使其成为理想的药物输送载体的特性也支持它们用作癌症治疗学。外泌体科学界最近开始探索许多已描述的用于外泌体分离的生物来源,并从中开发药物递送载体和治疗学。“机体外泌体”的想法尚处于起步阶段,但仍然是一个有吸引力的研究领域,以开发具有临床相关性的产品。虽然还有几个里程碑尚未实现,但在EV领域取得了巨大进步,外泌体在癌症治疗、诊断和临床治疗中的成功应用并不遥远。图2:外泌体和携带阿霉素的金纳米颗粒合成的混合递送系统参考文献:Organically derived exosomes as carriers ofanticancer drugs and imaging agents for cancer treatment. Semin Cancer Biol.2022 Feb 19:S1044-579X(22)00047-5.外泌体资讯网 【综述】Semin Cancer Biol丨机体来源的外泌体作为抗癌药物和癌症显像剂的载体