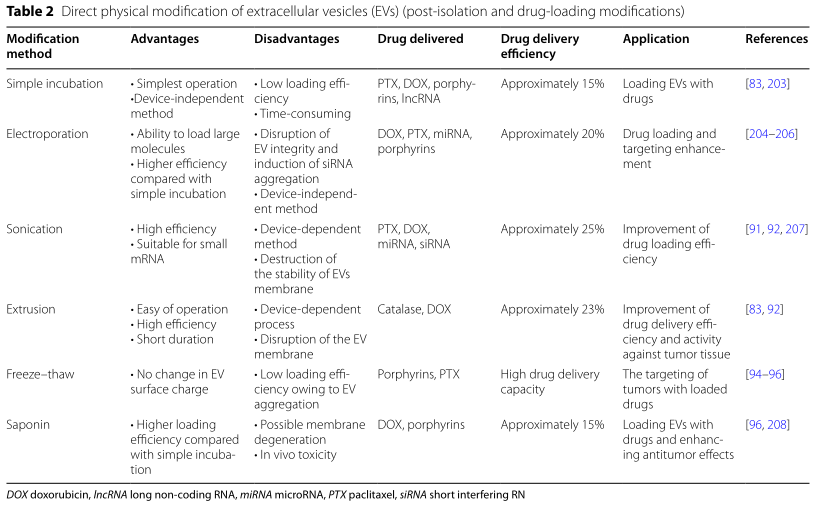
绝大多数细胞都能释放胞外囊泡(EVs)。EVs含有许多能参与细胞或者组织之间信号传递的生物成分,包括RNA和蛋白质等,对于维持正常的细胞间通讯和内部环境的动态平衡必不可少。EVs杰出的生物特性和功能(如肿瘤靶向性和优异的穿透能力)使其成为药物输送和精确治疗的潜在新选择。不同组织来源的细胞外囊泡因包含不同的成分而在生物学功能上存在差异,这限制着细胞外囊泡的有效分离;因此,将细胞外囊泡应用于临床的首要挑战是如何优化其分离方式。此外,尽管EVs已经被证明可以运输用于肿瘤治疗的抗肿瘤药物,但是进一步提高EVs的肿瘤靶向性和药物负载效率已迫在眉睫。近日,来自中国医科大学附属第四医院普外科姜晓峰教授团队的研究人员在Journal of Biomedical Science上发表了题为“Applicationof engineered extracellular vesicles for targeted tumor therapy”的文章(DOI: 10.1186/s12929-022-00798-y)。该综述全面地讨论了EVs在肿瘤靶向治疗应用中的最新进展;系统地总结了EVs的培养条件以及不同的EVs分离方法的优缺点;回顾了提高EVs靶向特异性和药物负载效率的手段;并概述探讨了不同的药物负载以及不同细胞来源的EVs在肿瘤靶向治疗和预后中的应用前景;提出了EVs在临床应用中所面临的挑战和未来发展方向。中国医科大学附属第四医院普外科姜晓峰教授和杨智医生为论文通讯作者,硕士研究生张富生和医生郭金帅为论文共同第一作者。首先,研究人员讨论了不同培养基对获得EVs的影响以及从不同部位获得规模化EVs的潜在可能;并提出了提高EVs产量的可能途径。EVs获得后,在将基于EVs的药物递送系统转化为临床前,必须克服重要的挑战。需要探索用于大规模纯化同质EVs群的有效分离方法。因此,作者比较了目前常用的一些分离手段(Table1)(比如超速离心、超滤法、色谱柱法、聚合物沉淀、免疫层析、微流体技术)并提出了一些可能有助于进一步提高EVs分离效率的建议。EVs的生物相容性和靶向特异性支持其作为药物载体应用于抗肿瘤治疗。然而,对于自然发生的EVs来说,其肿瘤靶向性以及药物负载效率仍需进一步提高。因此,作者总结了常用于提高肿瘤靶向性和药物负载效率的EVs工程化方式,包括化学修饰(共价/非共价修饰、静电相互作用)、物理修饰(表面修饰和内容物加载)和亲本修饰(遗传工程和代谢工程),并对它们各自的优缺点做了详尽描述 (Table 2)。此外,不同来源的EVs在生物性质上存在差异。对此,研究人员先评估了加载于EVs的主要抗肿瘤药物类型,并描述了基于EVs的共载药系统(脂质体和水凝胶与EVs结合)在药物传递方面的应用前景。在某些层面上说,免疫细胞分泌的EVs具有亲本细胞的免疫调控功能,因此利用免疫细胞分泌的EVs加载抗肿瘤药物也许会进一步提升肿瘤治疗效果。所以,作者们根据间充质干细胞、巨噬细胞、树突状细胞、自然杀伤细胞的不同生物特性总结了这些免疫细胞分泌的EVs作为抗肿瘤药物载体的潜力(Table 5)。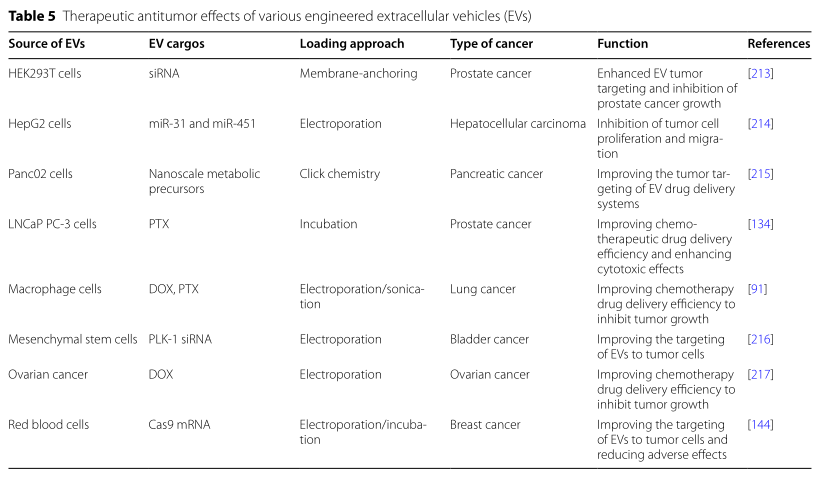
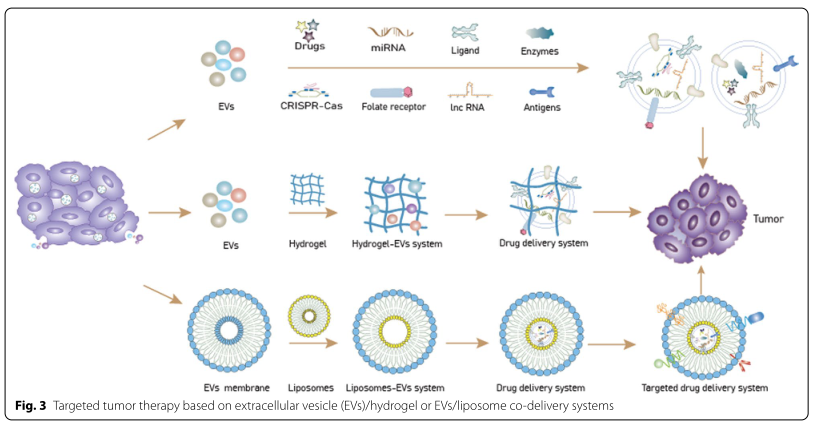
总的来说,作者对EVs在肿瘤靶向治疗中的应用前景做了全方位的描述,从EVs的培养和分离提取,到EVs的储存和工程化,再到EVs的临床应用潜力及面临的挑战(药物加载和共载药系统)。旨在为对EVs肿瘤治疗领域感兴趣的读者提供更直观而清晰的视野。参考文献:
Application of engineered extracellularvesicles for targeted tumor therapy. J Biomed Sci. 2022, 21;29(1):14.doi: 10.1186/s12929-022-00798-y.
外泌体资讯网 J Biomed Sci | 中国医科大学附属第四医院普外科姜晓峰教授团队: 工程化细胞外囊泡在肿瘤靶向治疗中的应用