基于细胞外囊泡(EV)的疗法和疫苗正在兴起。然而,EV的大规模生产始终是一个巨大的瓶颈。为了克服这样的障碍,近日,佛罗里达大学的Mei He教授在JEV杂志发表文章,报道了一种简单直接的方法,通过利用基于光疗的光感应来促进树突状细胞衍生EV(DEV)的细胞生产。在光波长、强度和曝光时间的优化下,DEV生产率提高了13倍以上,同时保持了生产的EV良好的整体质量和免疫功能。
树突状细胞(DC)疗法或基于DC的疫苗开发已经出现在癌症免疫疗法中,因为DC是最有效的抗原呈递细胞,并且是肿瘤特异性免疫反应的关键引发剂。然而,由于DCs在体外和体内的不稳定特性,目前的临床转化和试验开发存在不一致和低效的问题。在大量人群中实施DC治疗成本高昂,难以长期储存,并且需要明确的质量控制。与DCs相比,分泌的细胞外囊泡(EVs)具有优越的特性,可以克服基于细胞的免疫疗法的这些缺点,同时保持免疫调节和主要刺激分子,例如主要组织相容性复合物I类(MHC-I)和II类(MHC-II)、细胞间粘附分子-1(ICAM-1)、整合素和共刺激分子(例如,CD80、CD86)。目前,基于DEV的I期和II期临床试验已经在晚期恶性肿瘤患者中进行,具有可行性和良好的安全性。
然而,为治疗和治疗应用生产足够数量的EV极具挑战性。常规的细胞培养和分泌不能产生满足临床剂量需要的量。大量的细胞培养物必须培养数天。不幸的是,目前EV的纯效率仍然很低。提高细胞分泌率以高效生产EV一直是迫切需要的。已经进行了一些尝试,通过对其亲代细胞中的生物发生和回收途径的基因操作来增加EV的产量,例如基因工程的激活剂基因的过度表达或参与EV回收途径的ISGylation的下调。这种基因操作可以诱导不同于自然细胞分泌过程的细胞产生。据报道,一些与培养条件相关的方法可以产生更多的EV,例如热休克或辐射处理,用于引入外部刺激来控制细胞增殖、缺氧、炎症和剪切应力。最近,Lee研究小组报告了一种细胞纳米孔方法,通过局部和瞬时电刺激生产大量含有治疗性mRNA和靶向肽的EV,促进EV的释放高达50倍。然而,迄今为止,尚未探索过生产的EV如何改变免疫原性或对下游应用的治疗开发和药物递送产生影响,这是迫切需要的。为了解答这一问题,该报道介绍了一种简单而新颖的方法,通过利用基于光疗的LED灯来促进DEV的细胞生产,在优化的光波长、强度和曝光时间下,这可以显著增加13倍以上的EV生产。在更长的近紫外365nm波长下优化的光照条件不会损害细胞生长。与其他物理刺激(例如热休克和电刺激)相比,光处理相对简单、直接,并且可以根据制造规模的需求轻松适应细胞培养箱或生物反应器,无需特定的设备设置。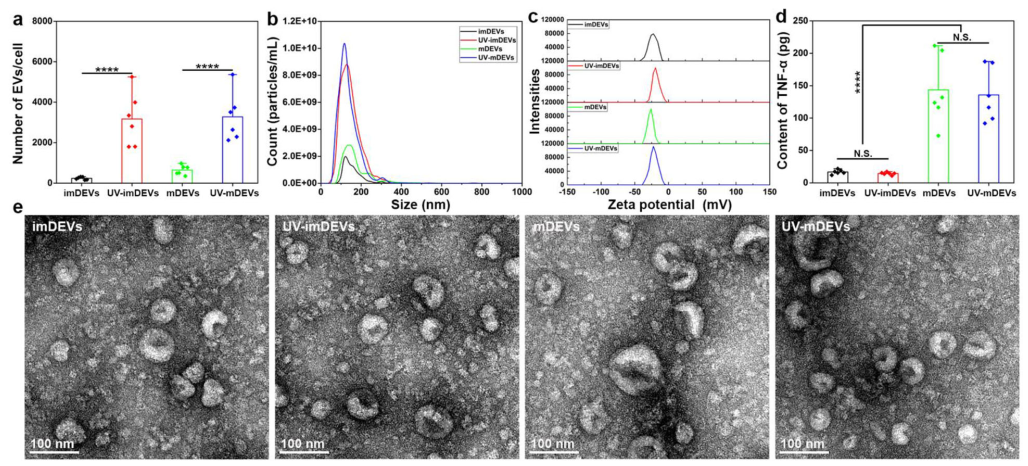
免疫原性和免疫调节功能是EV在我们人体中的核心作用,它们与其亲代细胞类型以及囊泡内和表面分子组成高度相关。DEVs通过携带膜和细胞质DC成分调节抗原呈递,包括MHC-I和MHC-II、ICAM-1、整联蛋白和T细胞共刺激分子(例如CD80和CD86),它们对于激活适应性免疫反应至关重要。越来越多的证据表明,DEV可以通过将MHC抗原复合物和共刺激分子直接暴露于T细胞,或通过将抗原传递给周围的DC间接调节免疫反应。为了评估光诱导产生对这种EV免疫功能的影响,作者研究了来自未成熟DC和成熟DC的光处理产生的EV的三种主要免疫标志物,包括MHC-I、MHC-II和CD86,与没有的对照组相比,它们没有显示出显著变化。来自其亲本未成熟(imDC)或成熟DC(mDC)的光促进EV的免疫调节功能、免疫原性、氧化应激水平和生物相容性在体外和体内也与天然产生的EV相当。关于光促进DEV的生物分布的体内动物研究表明,与天然衍生的DEV具有非常高的相似性(>98%)。来自小鼠脾脏和淋巴结的单细胞悬浮免疫细胞的免疫分析显示光促进的DEV和天然衍生的DEV之间没有差异,并且两者都具有良好的耐受性。免疫诱导具有高度可比性,没有安全问题。相比之下,光驱动的DEV显著提高了生产率。作者预计这种简单的方法可以作为一种有效的策略,用于高速生产具有良好免疫原性的EV,作为药物输送载体或治疗剂,这可以解决开发基于DEV的疗法的临床转化中的瓶颈挑战。Ruan S, Erwin N, He M. Light-induced high-efficient cellularproduction of immune functional extracellular vesicles. J Extracell Vesicles.2022 Mar;11(3):e12194. doi: 10.1002/jev2.12194. PMID: 35230743.外泌体资讯网 JEV:光照将树突状细胞的囊泡分泌量提高13倍以上






