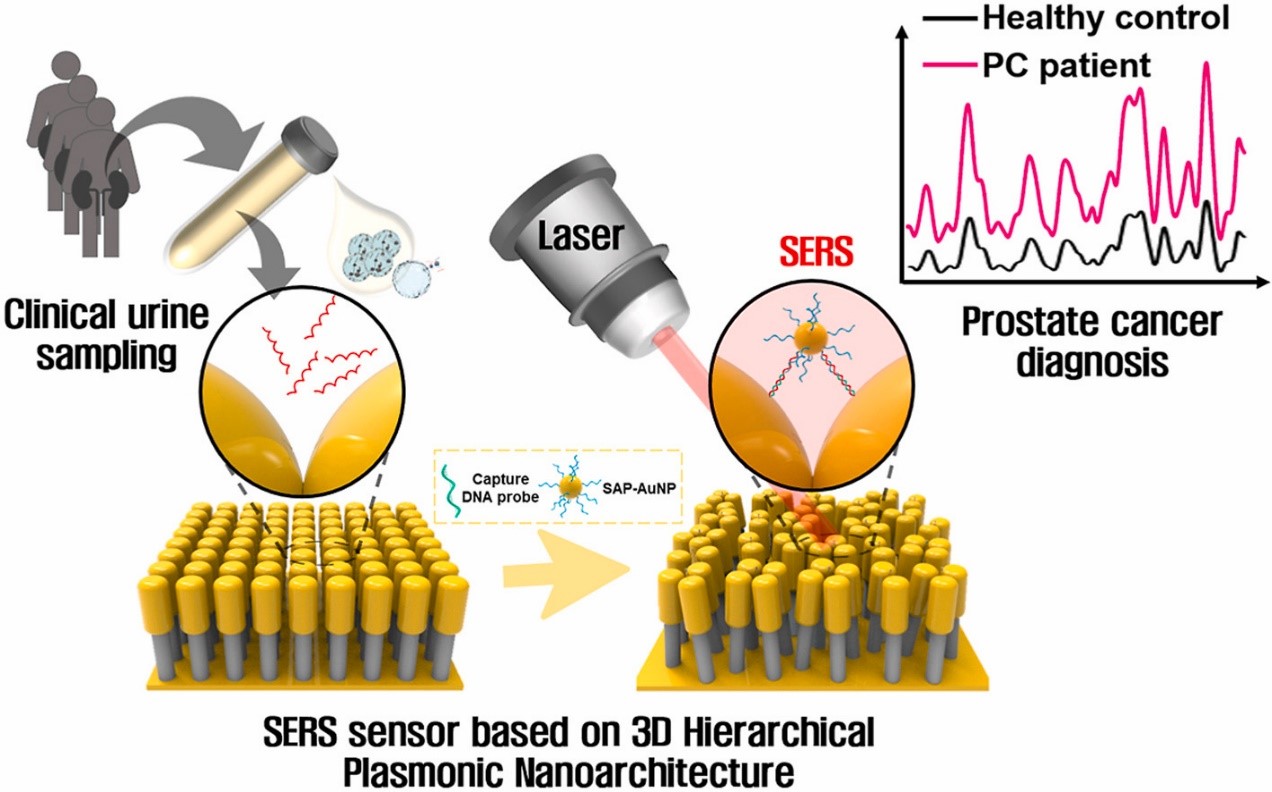
尿液外泌体miRNAs是新兴的前列腺癌相关生物标志物,然而由于miRNA的丰度低且序列同源性高,开发一种高精度的尿外泌体miRNA检测方法具有挑战性。来自韩国高丽大学的研究人员提出了一个定量和无标记的miRNA传感平台,该平台使用基于三维 (3D) 分层等离子体纳米结构的表面增强拉曼散射 (SERS) 来检测尿外泌体miRNA。该研究发表于Biosens Bioelectron杂志上。
前列腺癌 (PC) 是全球男性中第二常见的恶性肿瘤和第五大癌症相关死亡原因。血清前列腺特异性抗原(PSA)检测被认为PC诊断和预后的标准。然而,许多研究报告称,PC的PSA检测缺乏特异性和准确性,导致假阳性率高达76%。这种高假阳性率往往会增加大量不必要的活检。由于使用PSA作为生物标志物无法区分惰性PC和侵袭性PC,引发过度诊断和过度治疗。因此,迫切需要新型PC特异性生物标志物用于准确可靠的诊断。最近的研究表明,肿瘤衍生的外泌体揭示了有关癌症发病机制的见解,包括肿瘤生长、转移和肿瘤血管生成。这些纳米囊泡介导肿瘤微环境中的细胞间通讯,并通过将癌症特异性分子特征(包括蛋白质和核酸)从肿瘤细胞转移到正常细胞来诱导靶细胞的恶性转化。此外,肿瘤细胞分泌的外泌体至少是正常细胞的10倍。外泌体miRNA是小的非编码单链RNA,在转录后调节基因表达。由于PC的异质性,尿液外泌体miRNA因其显著的稳定性和数量规模大而被广泛研究作为诊断PC的新兴生物标志物。此外,尿液外泌体miRNA的表达直接与泌尿生殖癌的器官功能相关。外泌体miRNA-21(miR-21)已被证实为PC的致癌基因,通过p53网络调节多个肿瘤相关基因的表达,促进PC细胞增殖和侵袭。此外,外泌体 miRNA-10a (miR-10a) 是PC中的一种致癌miRNA,诱导正常细胞转化为癌症干细胞。因此,许多研究团队开发了用于诊断PC的miR-10a和miR-21检测平台。 检测血液或生物体液中miRNA 的常规方法包括Northern印迹、qRT-PCR、微阵列和基于荧光的技术。使用荧光标记方法耗时长和成本高。此外,灵敏度低的常规方法需要额外的扩增过程或利用大量样本来检验外泌体的生物流体。因此,迫切需要开发一种前处理过程简单、灵敏度高、选择性高、动态检测范围宽、检测性能优良的前列腺癌传感检测平台。基于表面增强拉曼散射(SERS) 的利用金属基底或纳米粒子的光学生物传感器作为一种有前途的技术而备受关注,因为它为吸附在粗糙金属纳米结构上的单个生物分析物提供了特定的“指纹”光谱分布。与未增强的拉曼信号相比,来自金属纳米结构的信号通过局部表面等离子体共振被放大6到14个数量级。然而,由于背景信号强,SERS在复杂临床样本中的适用性受到限制,尤其是在目标生物分子浓度极低的情况下。为了在临床样本中使用无标记SERS检测,开发具有足够高灵敏度和选择性的SERS生物传感器至关重要。3D等离子体纳米结构可以提供更高的SERS效应,因为3D等离子体纳米结构上的入射电场在SERS活性位点被显著放大。增强效果能够识别单个分子的拉曼光谱指纹,从而克服了传统拉曼信号中的低灵敏度和识别多个分析物的困难。因此,二者的结合合并了分子指纹特异性和单分子敏感性能够检测多种miRNA。在本研究中,研究人员提出了一种非常灵敏的SERS生物传感器,用于无标记和定量检测尿液样本中与PC相关的外泌体miRNA。该传感器是由自组装DNA探针共轭金纳米粒子(SAP-AuNPs)和头部植绒金纳米柱在靶miRNA存在下自组装构建的,产生大量3D等离子体热点,诱导SERS 信号的极高放大。这种3D SERS生物传感器对目标miRNA(miR-10a 和 miR-21)实现了约10 aM的检测限,其灵敏度比之前报道的miRNA传感器高1000 倍以上,无需任何标记或预处理步骤。最后,使用尿液样本的临床验证表明,3D SERS传感器基于尿液外泌体 miRNA的差异表达水平以高诊断准确度区分PC患者与健康对照。这表明,基于3D分层纳米结构的SERS传感器可以提供简便、准确和快速的方法来测量miRNA 表达,并有助于诊断各种疾病。参考文献:Three-dimensional hierarchical plasmonic nano-architecture basedlabel-free surface-enhanced Raman spectroscopy detection of urinary exosomalmiRNA for clinical diagnosis of prostate cancer. Biosens Bioelectron. 2022 Feb25;205:114116.外泌体资讯网 BiosensBioelectron丨基于三维分层等离子体纳米结构的表面增强拉曼光谱检测尿液外泌体miRNA