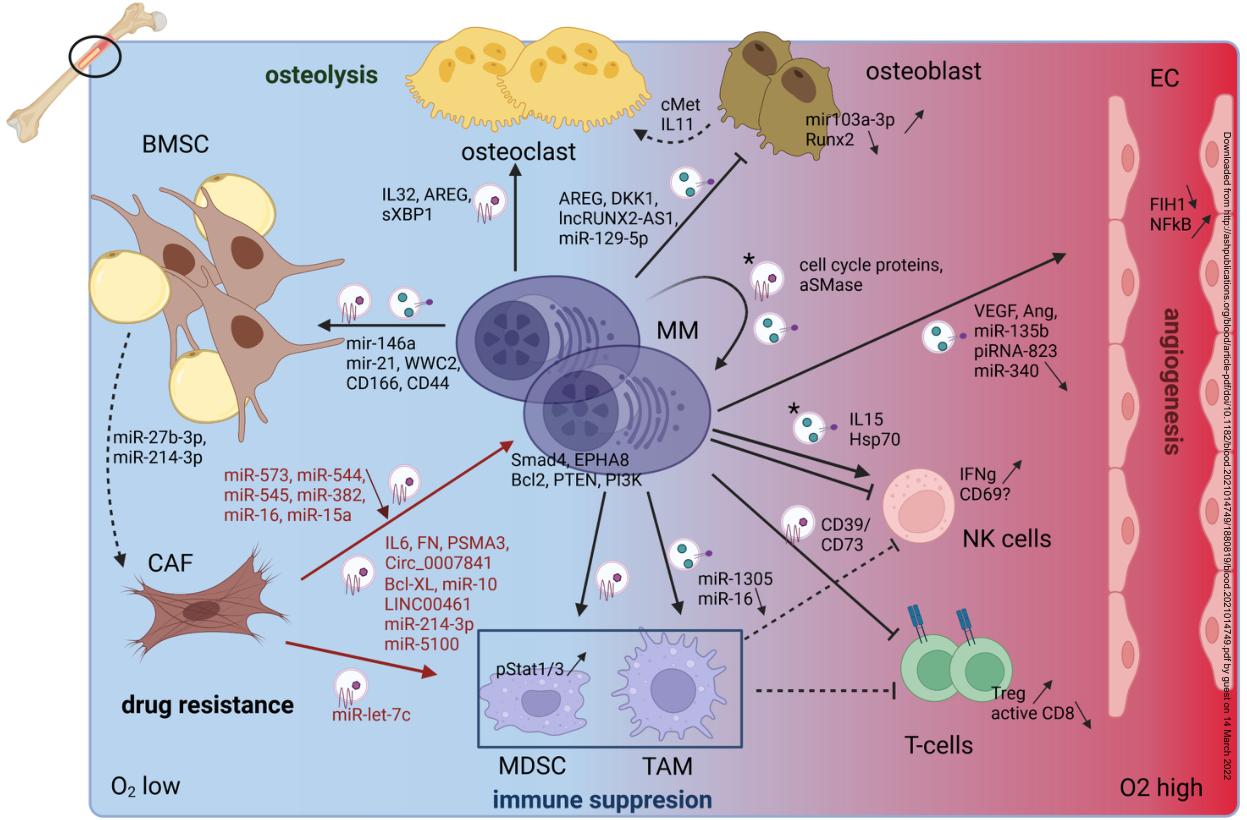
目前,多发性骨髓瘤 (MM) 仍然是一种在骨髓中发展的无法治愈的浆细胞恶性肿瘤。越来越多的证据表明包括外泌体的细胞外囊泡涉及了MM发展的各个过程。近日,来自布鲁塞尔自由大学的研究人员在杂志上发表综述,总结了MM中外泌体的功能、潜在价值和临床应用。 多发性骨髓瘤 (Multiple myeloma,MM) 发病原因是恶性浆细胞 (plasma cells,PC) 在骨髓 (bone marrow,BM) 内扩增,导致典型症状,如骨病变、贫血、高钙血症和反复感染。目前全球发病率为1/160000。MM的癌前无症状阶段通常称为未确定意义的单克隆丙种球蛋白疾病 (MGUS)。 15%的MGUS患者将发展为MM,或是郁积型多发性骨髓瘤 (smoldering MM,SMM) 的中间状态。目前,MM患者的分级是通过BM中的PC百分比,其中PC 的定义为CD138+/CD38+细胞。由于CD138 可以从细胞膜上分离,因此需要新的生物标志物来对MM进行鉴定。尽管开发了新的治疗策略,但MM仍然无法治愈,大多数MM患者会复发并且对所有疗法都失效。众所周知,BM微环境在进展和复发中起着至关重要的作用。人们投入大量精力寻找治疗靶点通过了解肿瘤微环境通讯机制。近年来,出现了一种新的通信方式,即分泌型细胞外囊泡(EVs)。这些EV范围涵盖一群异质的囊泡,由微泡 (MV)、凋亡小体、外泌体和exomeres组成,具体取决于它们的大小和分泌途径。凋亡小体是最大的EVs (1-5µm),在细胞凋亡的晚期从质膜释放,而MVs 是大小范围为 100nm-1µm 的异质囊泡组,从质膜中起泡。Exomeres(或译为小外泌颗粒)是最小的(<50 nm)非膜性囊泡。在这篇综述中,研究人员讨论了外泌体exosomes在MM发展和治疗中的作用及其作为生物标志物的可能价值。在这篇综述中,研究人员总结了BM中外泌体相关过程的最新发现,不仅描述当前对抗外泌体的治疗策略,还描述如何利用外泌体传递药物。研究人员还讨论了外泌体货物作为液体活检中潜在MM生物标志物的不同临床研究。外泌体是由包括MM细胞在内的各种细胞分泌的 <150 nm的囊泡,这些囊泡含有蛋白质和RNA 货物,传递给受体细胞。通过这种方式,外泌体与MM相关的生物过程有关,包括骨溶解、血管生成、免疫抑制和耐药性。因此,靶向外泌体分泌可能会阻止这些不同的肿瘤恶性转变过程。上图:外泌体在MM微环境中的作用。MM细胞存在于缺氧的BM环境中,这将触发MM EV的释放。这些EV将通过提供包括VEGF、miR-135b和piRNA-823 在内的促血管生成货物来刺激血管生成。通过EV货物(AREG、IL32 和 sXBP1)的递送诱导破骨细胞增殖和活化,以及通过AREG、DKK1、lncRUNX2-AS1、miR129-5p 等抑制性货物阻断成骨细胞分化和活性,激活骨溶解。此外,成骨细胞被刺激分泌cMet和IL11作用于破骨细胞。由CD73和CD39以及通过miR 1305 EV递送激活MDSC和TAM诱导免疫抑制,它们反过来会抑制 NK和T细胞增殖。MM EVs 通过抑制CD8激活和诱导Treg扩增对T细胞产生直接影响。EV对NK细胞的直接影响尚无定论。最后,MM细胞通过将mir-146a、mir-21、WWC2和 CD166、CD44作为EV货物来触发BMSC转化为CAF。 研究人员也对未来MM中外泌体研究进行了展望。包括外泌体在内的EV在为解决MM诱导的BM变化和耐药性都提供了有吸引力的治疗靶点,然而,一些未解决的问题包括缺乏选择性和对外泌体分泌途径的深入了解不足,限制了其临床转化。对不同分泌途径的了解可以找到一些靶点,该靶点可能对某些不需要的货物的释放具有高度特异性。此外,由于使用外泌体作为药物输送载体更接近于临床实施,因此了解这些分泌途径对于更好地了解某些货物如何整合到外泌体中也是必要的。在生物标志物研究方面,MM相关研究的数量明显增加,尤其是小RNA。然而,对于哪种货物是最好的EV生物标志物,目前还没有达成共识。目前,EV分析不应取代活检,但可用于预测风险分级。在生物标志物方面,未解决问题包括寻找临床上可行的EV分离方法以及排除不相关的其他种类EV释放的干扰。此外,更复杂的“组学”方法的发展很可能会加快这一领域的发展。总之,本综述报告的研究强调了外泌体在 MM中的潜在用途,既可作为治疗靶点,也可作为液体活检的潜在材料。参考文献:Exosomes in Multiple Myeloma: from bench to bedside. Blood. 2022 Mar10:blood.2021014749.外泌体资讯网 Blood丨外泌体在多发性骨髓瘤诊疗中的应用——从实验室到临床