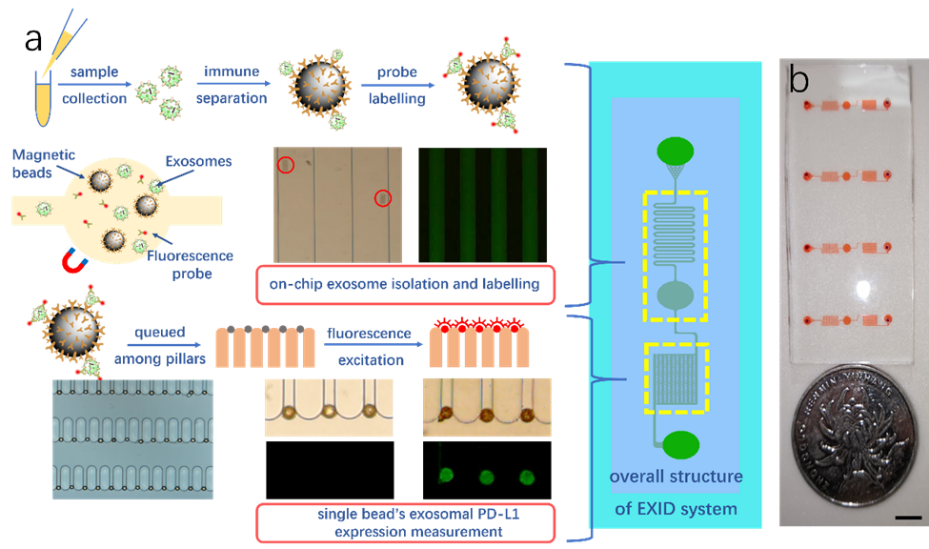
外泌体是人体细胞分泌的一种纳米尺寸微小囊泡,其携带来自亲代细胞的信号分子与遗传信息,在肿瘤发生、发展,原发灶转移,免疫逃逸等方面起到重要作用。因此,肿瘤相关外泌体可作为肿瘤伴随诊断与个体化治疗的一种液体活检标志物。然而,由于外泌体尺寸(30-150nm)很小,临床样本外泌体分离及检测面临一定挑战。微流控技术由于其灵敏度高、试剂消耗量低、反应时间快等独特优势,为外泌体的分离和检测提供了一种很有前途的解决方案。
近日,中国科学院上海微系统与信息技术研究所毛红菊研究员团队与西南医科大学附属医院韩云炜教授合作在Biosensors and Bioelectronics杂志上发表了题为“Integrated microfluidicsystem for isolating exosome and analyzing protein marker PD-L1”(2021 Dec 21;204:113879)的研究。该工作研发了一种基于微流控技术的应用于外泌体PD-L1蛋白检测的新式集成一体化分析芯片(EXID),能够高效灵敏地检测血清外泌体表面PD-L1表达水平,实现了无需样本预处理的集成化外泌体分离及其PD-L1检测,具有样品消耗低,操作时间短,检测灵敏度高等优势。
肿瘤细胞表达的PD-L1可以与活性T细胞上的抑制受体PD-1结合并抑制它们的激活,导致癌症患者预后不良。PD-L1的检测对免疫治疗的类型鉴别有辅助作用,但传统的方法,如肿瘤组织活检具有侵入性,患者体验较差。外泌体作为一种非侵入性液体活检标志物,在PD-L1检测中的应用越来越受到关注。
如何实现高效、廉价且适用于实时诊断的外泌体分离和检测仍然是相关领域研究人员关注的重点。目前,最经典的外泌体分离方法是超速离心法和超滤法。这种方法通常成本高,耗时长,而且可能包括其他类似大小或密度的囊泡或大的蛋白质聚集物。同时,传统的外泌体蛋白检测技术,如ELISA、western blot、流式细胞术需要大量的生物样本进行分析,在许多情况下应用有限,且不适用于快速、低样本量的液体活检需求。
为了解决上述问题,该研究中,研究人员开发了一种便捷、灵敏、高效、低成本的微流控操作平台——外泌体分离检测芯片(Exosome Isolation and Detection system, EXID system),该系统基于免疫荧光标记法的检测原理,可以实现集成化外泌体片上分离,荧光探针标记以及高通量荧光信号统计分析。从临床中获得的血清样品可直接进行检测,同时在自行开发的微柱阵列中进行分析,避免了荧光信号串色导致的干扰,提高了检测灵敏度,实现“sample in,result out”的目标。检测灵敏度可低至10个外泌体/μL,同时全片上处理过程避免了潜在污染风险,降低了样品与试剂消耗,即用即弃,具有潜在的临床应用前景。
结果显示,利用EXID system检测对7种不同细胞系来源的外泌体样品进行了区分,成功辨别了PD-L1表达差异化的样品。此外,对于来自16名临床患者与志愿者的实际血清样品检测中,PD-L1表达水平呈现出类间差异性,与临床结果具有较好的一致性。上述结果展示了EXID系统对于外泌体蛋白检测的能力,以及基于外泌体PD-L1检测在临床伴随诊断中潜在的应用前景。
参考文献:
Integrated microfluidic system forisolating exosome and analyzing protein marker PD-L1. Biosens Bioelectron. 2022May 15; 204:113879.
外泌体资讯网 Biosens. Bioelectron |中科院上海微系统所毛红菊团队:集成微流体系统用于分离和分析外泌体蛋白标记物PD-L1