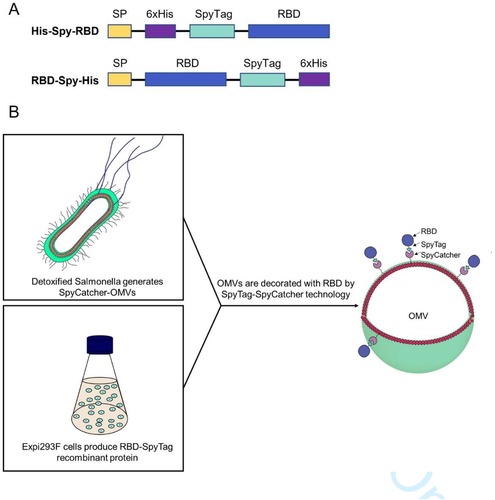
近期,新冠病毒引起的疾病正在国内和全球大流行中。全球疫苗接种工作取得了越来越大的成功,但未来可能需要额外的新技术来解决疫苗稳定性和储存要求、对疫苗增强剂的需求、不同给药途径以及对各种病毒变体的有效性。来自美国约翰霍普金斯大学的研究人员提出了一种新的、特征良好的 SARS-CoV-2候选疫苗,该疫苗基于鼠伤寒沙门氏菌的细胞外囊泡 (EV) 并装饰有哺乳动物细胞培养衍生的新冠棘突蛋白 (SPIKE) 的受体结合域(RBD),并对野生型和Delta变体产生了明显中和抗体活性。该研究发表于J Extracell Vesicles杂志上。 图:该疫苗的表达结构和OMV装饰的示意图。(A) 与N端和C端SpyTag 融合的RBD重组抗原的设计。(B) RBD-OMV生产示意图。新型严重急性呼吸综合征冠状病毒(SARS-CoV-2) 引起了COVID-19大流行,对快速疫苗开发的需求非常迫切。目前SARS-CoV-2疫苗包括含有mRNA(编码 SARS-CoV-2 的表面刺突蛋白)的脂质纳米颗粒或腺病毒载体组成,以及灭活的病毒或蛋白质亚基。这些可用的疫苗已经对新冠产生了显著的保护作用,全球疫苗接种工作在许多国家取得了巨大成功。尽管取得了这些进展,但稳定性和存储要求、反应速度和生产可扩展性等因素,导致需要寻找新方法去对抗SARS-CoV-2新变种或未来新兴病毒。SARS-CoV-2 在COVID-19大流行期间积累了突变,由于传播增加、逃避疫苗诱导的免疫反应,一部分谱系被指定为“担忧变体”(variant of concern)。B.1.6.17.2 (Delta)变体已成为几个国家的主要谱系,据报道它比以前发现的变体更具传播性,并且接种辉瑞和Moderna疫苗后无效。在这项研究里,研究人员提出了一种基于细菌细胞外囊泡 (EV) 的新型SARS-CoV-2 候选疫苗,这些细胞外囊泡 (EV) 装饰有Spike受体结合域 (RBD)。鼠伤寒沙门氏菌等革兰氏阴性细菌会产生称为外膜囊泡 (OMV) 的 EV。这些囊泡与其亲代细胞一样,在哺乳动物宿主中具有内毒素介导的免疫刺激特性,可驱动炎症并有效激活包括树突细胞、T细胞和B细胞在内的免疫细胞。尽管天然细菌OMV会引发破坏性的全身反应,但OMV也可以从工程化的内毒素减毒细菌中制备,从而避免这些负面反应。研究人员从一种减毒的鼠伤寒沙门氏菌菌株制备OMV,该菌株展示了一种带有SpyCatcher肽的毒力因子血红蛋白蛋白酶 (Hbp),用于偶联含有SpyTag的蛋白质货物。SpyTag/SpyCatcher系统能够通过在广泛的pH、温度和缓冲条件下稳定的共价酰胺键偶联蛋白质。该技术有效地将哺乳动物细胞培养中产生的 SpyTag-RBD融合蛋白与细菌OMV偶联,从而产生可被SARS-CoV-2抗体识别的RBD-OMV。此外,用RBD-OMV进行鼻内疫苗接种会引发抗体,产生针对野生型和Delta病毒变体的中和反应,并在仓鼠模型中提供了对SARS-CoV-2攻击的保护。参考文献:A bacterial extracellular vesicle-based intranasal vaccine againstSARS-CoV-2 protects against disease and elicits neutralizing antibodies towild-type and Delta variants. J Extracell Vesicles. 2022 Mar;11(3):e12192.外泌体资讯网 JEV丨基于细菌细胞外囊泡的新冠疫苗用于对抗野生型和德尔塔突变病毒