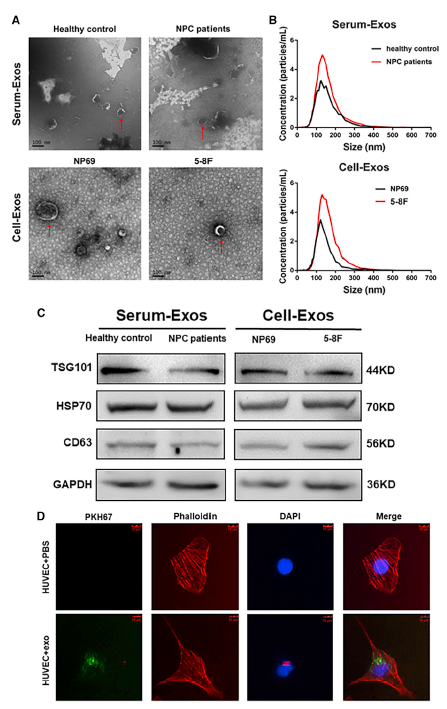
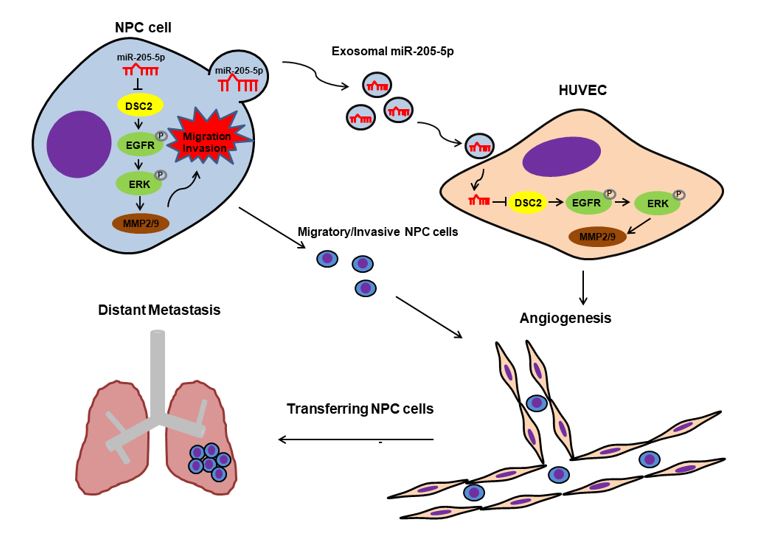
鼻咽癌(NPC)是我国常见的头颈部恶性肿瘤之一。目前,以放疗为主的综合治疗可以有效治疗NPC。然而,局部复发与远处转移仍然是NPC治疗失败的最主要原因。因此,揭示NPC远处转移的分子机制对NPC的临床治疗具有重要意义。近日,中南大学湘雅医学院附属肿瘤医院/湖南省肿瘤医院周钰娟、廖前进和王晖教授团队在Molecular Therapy – Oncolytics(IF=7.2)杂志上发表了标题为“Exosomal miR-205-5p enhances angiogenesis andnasopharyngeal carcinoma metastasis by targeting desmocollin-2”(2022 Mar 17;24)的研究。该研究发现,NPC细胞来源的外泌体可将miR-205-5p递送至血管内皮细胞,靶向DSC2 (desmocollin-2) 增强EGFR/ERK信号转导,诱导血管生成,促进NPC的转移。中南大学湘雅医学院附属肿瘤医院/湖南省肿瘤医院周钰娟教授、廖前进教授和王晖教授为论文的共同通讯作者,博士研究生杨雯娟、谭世铭为该研究做了大量工作。外泌体是一种直径在40-160 nm之间的小细胞外囊泡(sEVs),它起源于内体,通过受体介导的内吞、胞饮、吞噬作用或者直接与受体细胞膜融合等方式被受体细胞内化,释放生物活性物质(如miRNAs),从而建立细胞间通讯。此外,具有脂膜结构的外泌体miRNA生物稳定性更好,不易降解,是一种生物活性更强的循环miRNA。在肿瘤微环境(TME)中,外泌体miRNA可以介导肿瘤细胞与血管内皮细胞之间的通讯,诱导肿瘤血管生成,这是肿瘤转移的先决条件之一(图1)。在这项研究中,研究人员采用外泌体miRNA测序筛选出NPC患者外周血血清样本中高表达的外泌体miR-205-5p,并在88例NPC患者血清样本中进一步验证了该结果,外泌体miR-205-5p的高表达与NPC的进展相关。结合生物信息学分析、荧光素酶报告基因实验与生物素标记的miRNA pull-down,研究者发现miR-205-5p可以直接与DSC2 3’UTR结合。外泌体miR-205-5p可以靶向下调DSC2的表达,进而激活EGFR/ERK信号调控MMP2/MMP9的表达,最终诱导血管生成并促进NPC细胞的侵袭迁移;恢复DSC2的表达则削弱外泌体miR-205-5p诱导的血管生成,并抑制NPC细胞的侵袭迁移(图2)。总而言之,这项研究不仅揭示了一种依赖于外泌体miR-205-5p诱导血管生成促进NPC转移的新作用模式,同时为NPC的预后判断与抗血管生成治疗提供了新的生物标志物。图1 文中图2示NPC分泌的外泌体miR-205-5p可进入血管内皮细胞中图2 外泌体miR-205-5p靶向DSC2诱导血管生成促进鼻咽癌转移的工作模式图 ExosomalmiR-205-5p enhances angiogenesis and nasopharyngeal carcinoma metastasis bytargeting desmocollin-2. Mol TherOncolytics. 2022, 15;24:612-623. doi: 10.1016/j.omto.2022.02.008.eCollection外泌体资讯网 Mol Ther Oncolytics | 中南大学/湖南省肿瘤医院:外泌体miR-205-5p促进鼻咽癌转移的功能与机制