胶质母细胞瘤(GBM)是成年人最为常见的原发性脑肿瘤。当前的标准治疗方案是最大限度的手术切除联合替莫唑胺(TMZ)化疗和放射治疗,然而患者的生存期仅为12-16个月。于GBM而言,使治疗性药物有效跨越BBB达到肿瘤部位,是亟需解决的重点问题。
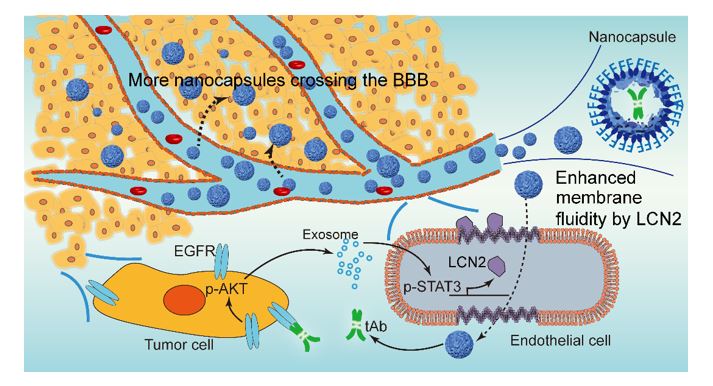
近日,天津医科大学总医院康春生教授团队与天津大学原续波教授团队在 Journal of controlledrelease杂志联合发表论文“Glioma-derived exosomes hijackthe blood-brain barrier to facilitate nanocapsule delivery via LCN2”(2022, 24;S0168-3659(22)00164-X),发现胶质瘤外泌体能够通过递送JAK-STAT相关蛋白,上调脑微血管内皮细胞脂质运载蛋白2 (LCN2) 的表达,进而提高内皮细胞膜流动性,影响纳米材料的吞噬这一作用机制。
外泌体是由细胞分泌的,能携带遗传物质和蛋白的小型细胞外载体,它能够介导细胞间的交流。许多肿瘤来源的外泌体都能够塑造肿瘤微环境,促进肿瘤的进展。例如,乳腺癌来源的外泌体,能够在不破坏BBB的情况下促进内皮细胞的胞吞转运,进而促进乳腺癌的脑转移。LCN2是多种肾病的标志物。近期发现LCN2能够帮助癌细胞适应和塑造肿瘤微环境,使得癌细胞在肝脏或脑脊液中更好的生存。在该文中,作者对胶质瘤外泌体与BBB的作用进行了研究,并明确了LCN2在其中的作用。
该团队曾经报道了2-甲基丙烯酰氧乙基磷酰胆碱(MPC)和肽交联剂能够包裹单抗形成纳米胶囊(nanocapsules),实现中枢神经系统治疗性抗体递送。给小鼠尾静脉或腹腔注射LCN2,发现进入脑内的nanocapsules显著增多。在正常小鼠和胶质瘤荷瘤小鼠中,LCN2都能促进nanocapsules跨越BBB。而这一过程并不会造成BBB的损伤。进一步研究发现,胶质瘤来源的外泌体,能够上调脑微血管内皮细胞中LCN2的表达量。外泌体的处理能够增强内皮细胞对nanocapsule-Cy5.5的吞噬,而敲低LCN2则能够逆转外泌体对纳米材料吞噬的促进作用。
为了探究外泌体和LCN2促进脑微血管内皮细胞吞噬作用的机制,研究人员检测了bEnd.3细胞膜流动性的变化。LCN2和外泌体的处理都能够增强细胞膜的流动性,而敲低LCN2后,外泌体对细胞膜流动性的促进作用被显著抑制。
为了明确LCN2是来源于外泌体的递送,还是内皮细胞中的表达,研究人员提取人脑胶质瘤分泌的外泌体,处理小鼠脑微血管内皮细胞bEnd.3,并对bEnd.3进行了蛋白质谱检测。对蛋白的种属分析显示,LCN2为鼠源,为内皮细胞分泌。对内皮细胞中人源的蛋白分析显示,JAK-STAT相关通路蛋白显著富集。已知LCN2受STAT3调控,一系列实验也证实,抑制STAT3能够阻断外泌体对LCN2的上调作用。
该团队前期报道过AKT抑制剂MK2206能抑制小鼠胶质瘤模型的进展。随后又报道过EGFR-AKT-PTRF通路在胶质瘤中促进外泌体的分泌。小鼠给药MK2206发现,脑部摄入的纳米材料显著降低,这可能是MK2206抑制了胶质瘤外泌体分泌,进而影响了BBB细胞膜流动性造成的。基于此,研究人员设计了针对小鼠胶质瘤模型的序贯治疗:先注射nanocapsule包裹的EGFR单抗Cetuximab,再给药MK2206,这样既能发挥MK2206对肿瘤的抑制作用,又能最大化的使治疗性抗体进入脑胶质瘤,得到最佳的治疗效果。
参考文献:
Glioma-derived exosomes hijack the blood-brain barrier tofacilitate nanocapsule delivery via LCN2. JControl Release. 2022, 24; S0168-3659(22)00164-X. doi:10.1016/j.jconrel.2022.03.038.
天津医科大学总医院杨超博士、武烨博士和王琳博士为本文的共同第一作者;天津医科大学总医院王琦雪副研究员、天津大学原续波教授和天津医科大学总医院康春生教授为本文的共同通讯作者。该研究得到国家重点研发计划纳米专项、国家自然科学基金和天津市科技计划的支持。
外泌体资讯网 J Control Release | 胶质瘤来源的外泌体能够通过调控LCN2的表达影响纳米材料跨越血脑屏障