唾液腺 (SG) 是包含分泌单位的外分泌器官,在放疗下易受损。来自泰国朱拉隆功大学的研究人员通过磁性3D生物组装 (M3DB) 平台制造了SG功能类器官和人牙髓干细胞 (hDPSC) 的3D培养物,通过提取这些组织的细胞外囊泡 (EV) ,作为SG损伤修复的潜在策略。该研究发表于Bioactive Materials杂志上。
放射治疗是晚期头颈癌患者的标准治疗措施,但是唾液腺 (Salivary glands,SG) 通常位于放射野上,会对产生唾液的分泌单位造成上皮损伤。放疗患者因此由于口干、吞咽困难、说话困难、龋齿、口腔粘膜炎等,他们的唾液流量显著降低,影响了这些癌症患者的日常口腔工作。然而,使用姑息性方法的常规疗法主要用于治疗SG的功能减退。因此,修复或替换受损或患病的SG分泌单位的治疗策略是必不可少的。
在过去的十年中,人们已经开发了各种类器官生物制造平台,最终帮助器官发生和新药发现目标之外的器官再生工作。类器官可以来自原代细胞或多能干细胞,比如在开创性的成人干细胞 (ASC) 的工作中,研究人员依赖于成年哺乳动物中快速自我更新的干细胞生态位开发了小肠上皮类器官。在这样的开创性报告之后,人们还使用类似的范例制造了乳腺、前列腺和SG等外分泌腺。然而,一些类器官平台依赖于使用异种衍生基质或支架,如Matrigel胶或层粘连蛋白凝胶,这在临床适用性方面面临挑战。因此,研究团队希望在没有异种衍生基质或支架的情况下生物制造SG类器官。
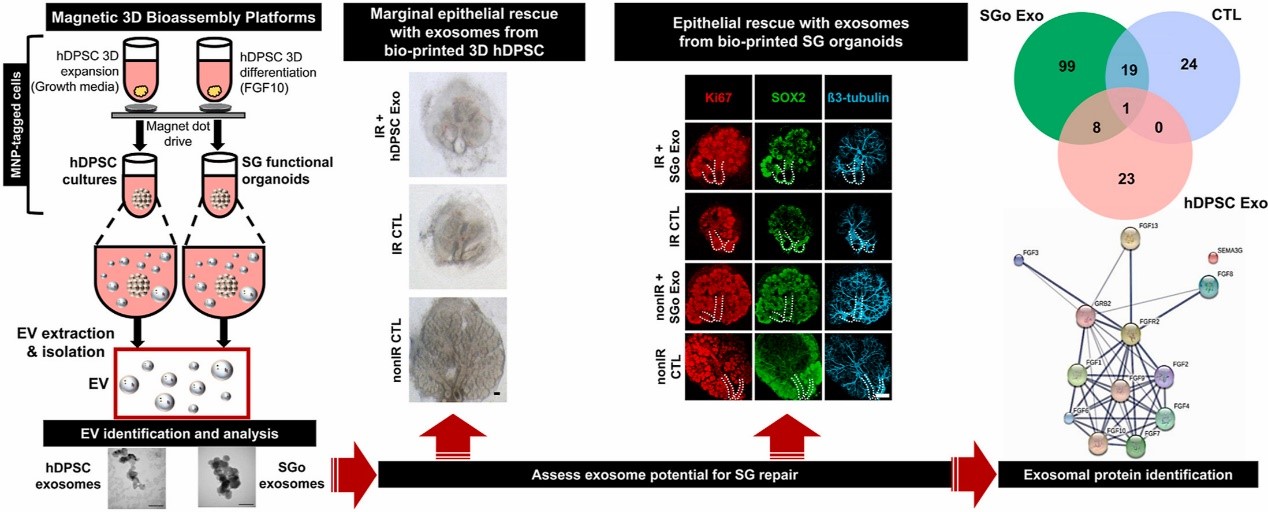
SG类器官发育的另一个问题是在整个培养过程中,上皮单位的分泌表型往往会丢失。研究团队最近在人类牙髓干细胞 (hDPSC) 的研究中,通过补充成纤维细胞生长因子10 (FGF10) 为SG类器官提供神经元网络,解决了这个问题。FGF10是SG形态发生和神经支配的关键信号线索,对于上皮组织隔室形成的SG类器官的不同区域(中央和外围)的持续神经递质刺激至关重要。有强有力的证据表明,这种神经支配对辐射损伤后的上皮干细胞/祖细胞(例如 SOX2+ 细胞)的修复至关重要。在研究团队之前的工作中,SG 类器官是用磁性三维生物组装 (M3DB) 平台开发的,这种类器官展现出上皮组织隔室,在移植后可以帮助受照射的SG中的上皮和神经元生长。这种治疗效果可能源于间充质衍生的ASC产生的分泌组或细胞外囊泡 (EV) 货物的旁分泌活性,这些ASC具有与SG类器官平台中使用的hDPSC相似的特征。因此,有必要在体外评估由hDPSC和SG类器官产生的EV,了解SG上皮修复是如何发生的,以及优化SG类器官平台同时增强关键EV旁分泌组分的释放。
因此,研究团队希望:(1)在由M3DB开发的hDPSC 3D培养和SG类器官的条件培养基中生成、分离和识别EV; (2) 用上述EV治疗上皮SG损伤后的生物修复状况的评估; (3) 确定EV中的新信号线索,这些信号线索可以优化类器官向上皮SG修复的发育。结果显示,通过 M3DB 培养11天后,SG功能类器官在神经刺激时显示具有功能特性的SG特异性腺泡上皮单位。为了在体外持续开发3D hDPSC,研究发现3天培养时间足以维持hDPSC未分化的基因型和表型以产生EV。通过连续离心hDPSC和SG类器官的条件培养基进行EV 分离。EV通过纳米粒子追踪分析、电子显微镜和免疫印迹来表征。hDPSC(直径:88.03 ± 15.60 nm)和 SG类器官(123.15 ± 63.06 nm)的EV均在外泌体范围内。在离体给药后,源自SG类器官的外泌体显著刺激受损SG中的上皮生长、有丝分裂、上皮祖细胞和神经元生长。然而,SG类器官EV这种生物效应与源自hDPSC的EV相比区别不大。接下来,通过蛋白质组学阵列研究这些外泌体生物学效应。SG类器官外泌体的质谱分析预测,FGF10下游的分子靶标涉及细胞生长、发育和信号传导。信号素Semaphorins被确定为需要进一步研究的新靶标之一。因此,M3DB平台可以产生具有改善SG上皮损伤潜力的外泌体。




