银屑病,又称牛皮藓,是一种常见的慢性炎症性皮肤疾病,是人类十大顽症之一,全球的发病率约为2%-3%,影响着1.25亿患者的正常生活。其主要的组织病理特征表现为炎症细胞浸润,炎症因子释放增加,角质细胞过度增殖、角化不全,真皮血管扩张。银屑病临床表现为出现红斑、鳞屑、斑块等皮损症状,皮损边界清晰,伴有剧烈瘙痒。皮损多见于头皮和四肢关节处,严重可累及全身各处。由于难以根治和易反复发作,银屑病患者需要长期服药,给患者、家人及社会都带来了沉重的经济负担。同时,银屑病患者皮肤会起红斑,瘙痒剧烈,产生大量鳞屑,影响外形美观,患者在日常生活和人际交往中会产生严重的心理问题,严重影响患者的生活质量。
作为一种系统性免疫疾病,不当的治疗或者不治疗,都会加重银屑病的进展,甚至引发严重的并发症,影响心血管系统和肝肾功能。当前,抗角质细胞增殖和免疫调节类药物(如糖皮质激素和免疫抑制剂)是中、重度银屑病的一线治疗用药,虽然这些药物能够很好的缓解银屑病的症状,疗效显著,但长期使用会干扰患者自身免疫系统的稳态,增加患者的感染风险、心血管疾病的发生率,甚至诱发肿瘤。因此,新型抗银屑病药物的研发仍然是当前研究的热点。
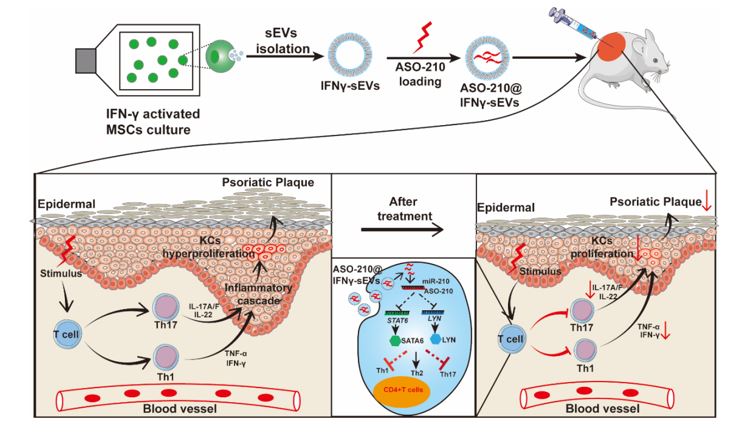
近日,中山大学药学院(深圳)的程芳副教授和陈红波副教授联合课题组在Frontiers in Cell and Developmental Biology上发表了题为“Small Extracellular Vesicles Derived From MSCs HaveImmunomodulatory Effects to Enhance Delivery of ASO-210 for PsoriasisTreatment”的研究论文(doi: 10.3389/fcell.2022.842813)。在这篇论文中,作者发现经IFN-γ刺激MSC后衍生的外泌体(IFNγ-sEVs)负载ASO-210协同治疗银屑病,效果显著。该研究为银屑病的治疗提供了一种新的治疗策略。
已有研究证明在炎症因子水平高的微环境下,MSC表现为免疫抑制作用,上调一些免疫抑制因子的表达,抑制炎症水平。目前,许多研究证实了,炎症微环境中的重要信号分子,如IFN-γ,TNF-α,IL17等炎症因子,可以激活MSCs的免疫抑制调节功能。因此研究者决定利用炎症因子IFN-γ刺激脐带间充质干细胞,提取外泌体,以增强其免疫调节能力。体外细胞实验和体内动物实验均证明经IFN-γ刺激脐带间充质干细胞后衍生的外泌体(IFNγ-sEVs)能够在银屑病小鼠体内抑制Th17细胞的增殖,抑制IL-17A,IFN-γ,TNF-α,IL-6等炎症因子的释放,从而抑制角质形成细胞的过度增殖,并能够很好的缓解红斑、鳞屑、斑块等银屑病皮损症状。
近二十年来,治疗性寡核苷酸的细胞内递送被认为是一种非常具有应用前景的疾病治疗方法。相比传统小分子药物和抗体药物,治疗性寡核苷酸(短DNA或者RNA寡聚体)疗法具有诸多优势,比如特异性强、靶点丰富、药物设计简单、药物作用持久等,但药物的稳定性和递送效率一直是临床转化的制约因素。
近年来,多种细胞来源的细胞外囊泡,包括外泌体、大囊泡、凋亡小体等,具有粒径小、稳定性高、免疫原性低、靶向特异性强等优点,被认为是核苷酸药物的理想纳米载药系统。
相关研究已表明miRNA210,在银屑病患者和IMQ或者IL-23诱导的银屑病小鼠体内,均存在高表达,诱导CD4+T 细胞向 Th17 和 Th1亚群分化,导致体内辅助性T淋巴细胞亚群免疫失衡,促进角质形成细胞的增殖,加重银屑病部位的炎症水平。基于此,研究人员用MSC-sEVs负载miRNA210的反义核苷酸药物ASO-210,旨在提高药物的稳定性和递送效率,降低药物的毒副作用,提高药物的治疗效果。体内动物实验证明,IFNγ-sEVs负载ASO-210后,银屑病的治疗效果显著提高。
综上,经IFN-γ刺激的脐带间充质干细胞衍生的外泌体通过免疫调节作用和靶向递送核苷酸药物ASO-210,可有效缓解银屑病的皮损症状,协同治疗银屑病。
参考文献:
Small Extracellular Vesicles Derived From MSCs HaveImmunomodulatory Effects to Enhance Delivery of ASO-210 for PsoriasisTreatment. Front Cell Dev Biol, 2022, 10: 842813.
外泌体资讯网 Front Cell Dev Bio|中山大学程芳/陈红波课题组:脐带间充质干细胞来源外泌体负载ASO-210用于缓解银屑病进展