RIG-I通路可被含有5'三磷酸的RNA激活,导致I型干扰素释放和免疫激活。因此,RIG-I激动剂已被用作潜在的免疫疗法来诱导针对癌症的免疫反应。然而,由于这些分子对降解的敏感性,在体内将5'三磷酸化RNA分子作为RIG-I激动剂递送至肿瘤细胞具有挑战性。近日,来自新加坡国立大学的黎月明(Minh Le)教授团队在JEV上发表文章,使用来自红细胞(RBC)的细胞外囊泡(EV)进行RIG-I激动剂递送,高效诱导抗肿瘤免疫反应。
近几十年来,从美国食品和药物管理局(FDA)突破性地批准干扰素-α2抗肿瘤细胞因子开始,免疫疗法的发展取得了长足的进步。从那时起,免疫治疗药物已扩展到包括抗肿瘤细胞因子、检查点抑制剂、过继转移T细胞疗法和癌症疫苗;越来越多的免疫治疗药物进入临床试验和实践。免疫疗法的关键概念认为肿瘤是包括宿主免疫细胞在内的肿瘤微环境的一部分,并且可以利用免疫系统来诱导抗肿瘤作用。
近年来,通过RIG-I样受体(RLR)途径激活先天免疫系统进行抗癌治疗一直是一个活跃的研究领域。当病原体感染细胞时,模式识别受体(PRR)——包括Toll样受体(TLR)、NOD样受体(NDLR)和RLR——识别外来病原体并激活抗微生物反应。RIG-I是一种胞质RNA传感器,可识别具有5'三磷酸部分的RNA序列,并以更高的亲和力与短双链RNA结合。有趣的是,高RIG-I表达水平与肝细胞癌患者的延长生存期相关,但与卵巢癌的不良临床结果相关。尽管RIG-I作为预后标志物的作用因癌症类型而异,但其激活始终诱导肿瘤细胞凋亡性死亡,并通过增加免疫细胞向肿瘤的浸润、增强其抗癌作用和降低免疫抑制活性来影响免疫反应。
一系列临床前证据一致认为,RIG-I激动剂在免疫治疗中的成功取决于癌细胞和免疫细胞对I型干扰素(IFN)的反应性。RIG-I激动剂的瘤内递送以I型IFN依赖性方式诱导胰腺癌细胞凋亡,并增强树突状细胞对CD8+T细胞的肿瘤相关抗原的有效交叉呈递,从而导致肿瘤消退和延长患有胰腺癌小鼠的生存期。用RIG-I激动剂在人源化小鼠模型中全身治疗急性髓性白血病(AML)可降低AML负担,延缓AML进展并使AML细胞对检查点阻断敏感。RIG-I激动剂的治疗效果高度依赖于CD8+和CD4+T细胞对I型IFN信号传导的适应性免疫。
由于包括小干扰RNA(siRNA)和反义寡核苷酸在内的许多治疗性RNA寡核苷酸正在被开发用于靶向许多曾经被认为无法成药的疾病基因,因此将基因敲低与RIG-I激活相结合是一种有吸引力的抗癌治疗方法。两个研究小组已经开发出针对BCL-2和TGF-β的双功能siRNA,具有5'三磷酸修饰以同时激活RIG-I。据报道,这两种双功能siRNA均可诱导抗肿瘤作用。
尽管它们具有巨大的潜力,但RNA疗法的临床应用仍然受到目前这些分子向靶细胞的低效递送的限制。RIG-I激动剂最广泛使用的体内递送载体之一是聚合物-jetPEI。虽然据报道它是有效的,但安全性是个问题。体内-jetPEI倾向于诱发肝损伤,并且与小鼠的低存活率有关,这种影响归因于其毒性。因此,开发一种有效且安全的递送方法对于RNA治疗至关重要。
黎月明博士(Dr Minh Le)团队之前曾报道过使用源自红细胞(RBC)的细胞外囊泡(EV)作为治疗递送载体的优势,因为它经济、易于获得、易于扩展、非免疫原性和非致癌性。分别通过肿瘤内和全身给药,在人乳腺癌和AML异种移植小鼠模型中证明了miR-125b的有效敲低和肿瘤生长的抑制。此外,没有观察到与RBCEV治疗相关的毒性。还描述了一种EV表面功能化方法,该方法有助于将载有紫杉醇的RBCEV靶向递送至EGFR阳性肺癌细胞并提高体内治疗效果。(相关报道:https://www.exosomemed.com/4724.html)
因此,在本研究中,作者试图评估RBCEV在递送RIG-I激动剂方面的有效性,包括用于抗癌治疗的免疫调节RNA(immRNA)和双功能ASO。immRNA是一种小型、稳定和高效的RIG-I激动剂,能够在巨噬细胞和树突状细胞中激活RIG-I和随后的抗病毒反应。作者假设递送具有5'三磷酸修饰(3p-125b-ASO)的immRNA或抗miR-125b ASO将诱导强大的抗癌反应。该报道证明了RBCEVs中的immRNA和3p-125b-ASO在体外诱导乳腺癌细胞和肺癌细胞中的RIG-I通路激活、I型IFN产生和凋亡。含有immRNA和3p-125b-ASO的RBCEV的瘤内给药可抑制乳腺癌的肿瘤生长,并在肿瘤微环境中引发高水平的I型干扰素、免疫细胞浸润和体内深度肿瘤细胞凋亡。此外,RBCEVs与EGFR靶向纳米抗体的结合促进了EGFR阳性乳腺癌细胞在体外对RBCEVs的特异性摄取。在EGFR阳性转移性乳腺癌小鼠模型中,靶向递送载有immRNA的RBCEV可改善特异性抗肿瘤免疫反应。
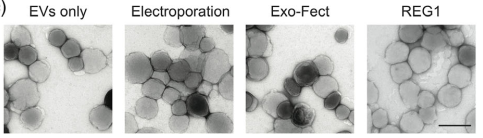
红细胞胞外囊泡(RBCEV)
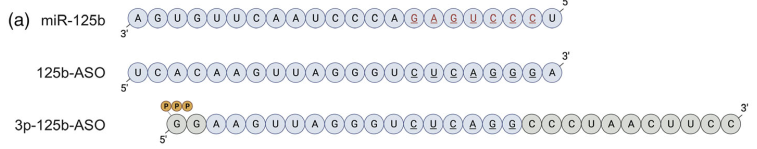
miR-125b序列和针对有和没有5'三磷酸的miR-125b的ASO设计
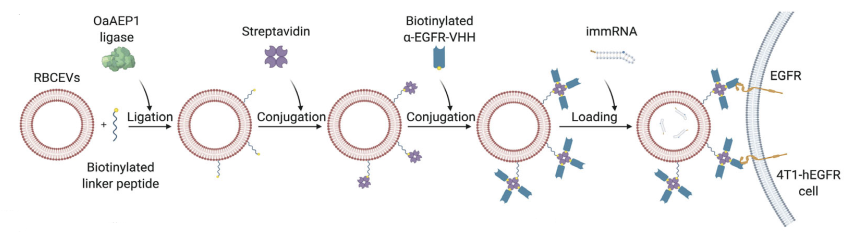
RBCEV修饰示意图:RBCEV与抗EGFR纳米抗体结合并装载immRNA
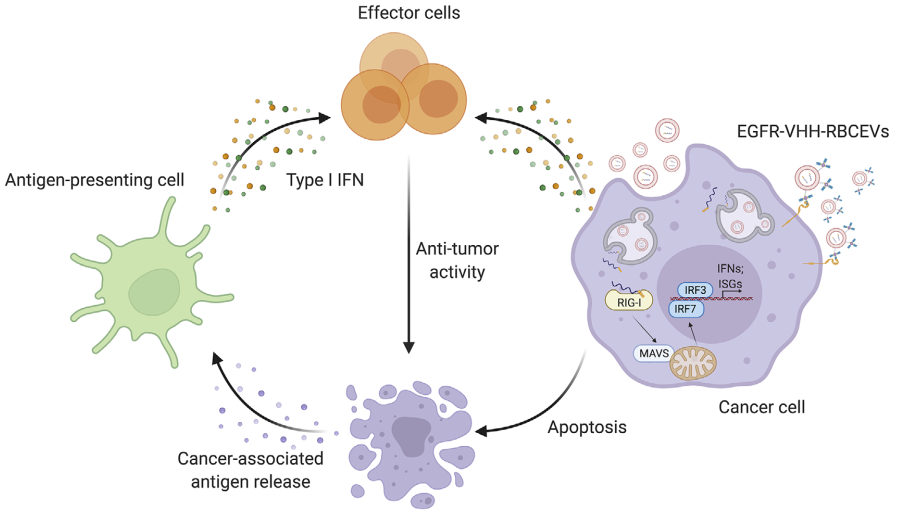
这些细胞外囊泡(EV)非常适合RNA负载并被癌细胞强烈吸收。评估了两种新型RIG-I激动剂的抗癌活性,免疫调节RNA(immRNA)具有用于有效RIG-I激活的独特二级结构,以及具有RIG-I激活和miR-125b抑制双重功能的5'三磷酸化反义寡核苷酸 (3p-125b-ASO)。研究发现RBCEV传递的immRNA和3p-125b-ASO触发RIG-I通路,并在小鼠和人类乳腺癌细胞中诱导细胞死亡。此外,在多次肿瘤内注射载有immRNA或3p-125b-ASO的RBCEV后,肿瘤生长受到显著抑制,同时免疫细胞浸润增加,这是由RIG-I级联激活介导的。使用RBCEVs和通过肺内给药的EGFR结合纳米抗体靶向递送immRNA有助于RBCEVs在转移性癌细胞中的积累,从而导致有效的肿瘤特异性CD8+T细胞免疫反应。这有助于显著抑制肺中的乳腺癌转移。因此,本研究提供了一种使用RBCEV有效递送RIG-I激动剂的新策略,用于针对癌症和癌症转移的免疫治疗。
使用RBCEV递送RIG-I激动剂的抗癌免疫治疗示意图
参考文献:
Peng B,Nguyen TM, Jayasinghe MK, Gao C, Pham TT, Vu LT, Yeo EYM, Yap G, Wang L, GohBC, Tam WL, Luo D, Le MT. Robust delivery of RIG-I agonists using extracellularvesicles for anti-cancer immunotherapy. J Extracell Vesicles. 2022Apr;11(4):e12187. doi: 10.1002/jev2.12187. PMID: 35430766; PMCID: PMC9013404.