肿瘤细胞衍生的细胞外囊泡(EV)正在作为循环生物标志物进行探索,但尚不清楚批量测量是否可以进行早期癌症检测。来自哈佛医学院的Ralph Weissleder教授团队在Science Advances杂志发表文章,研究发现单EV分析(sEVA)技术可提高癌症诊断的准确性。
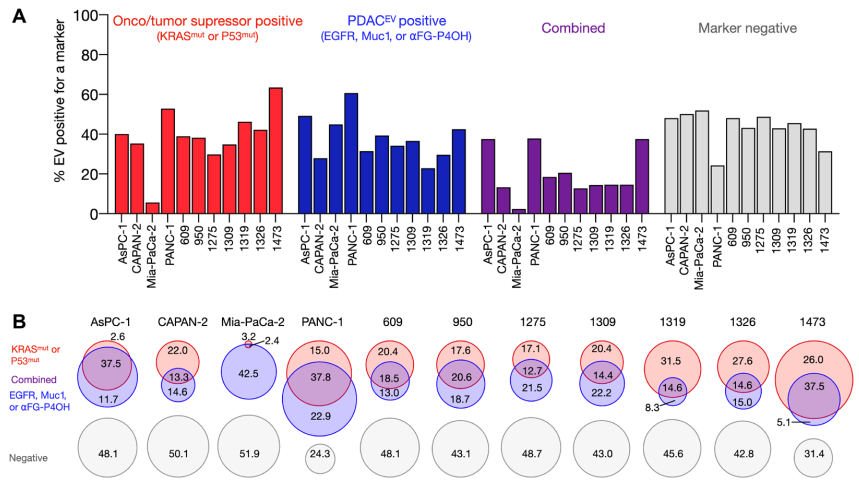
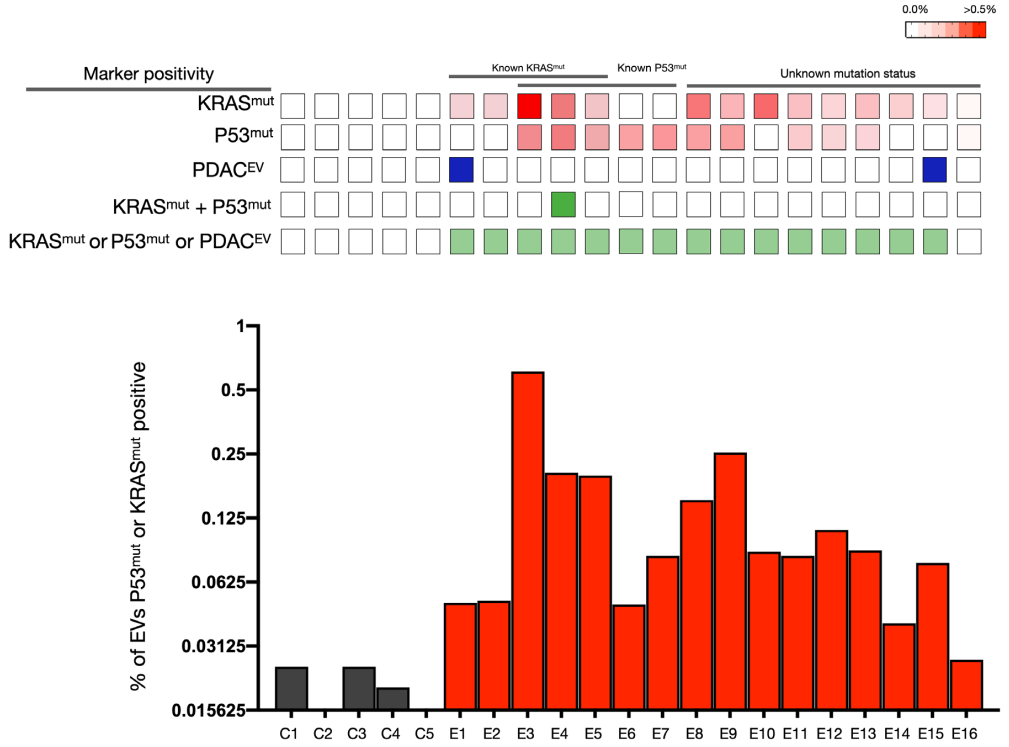
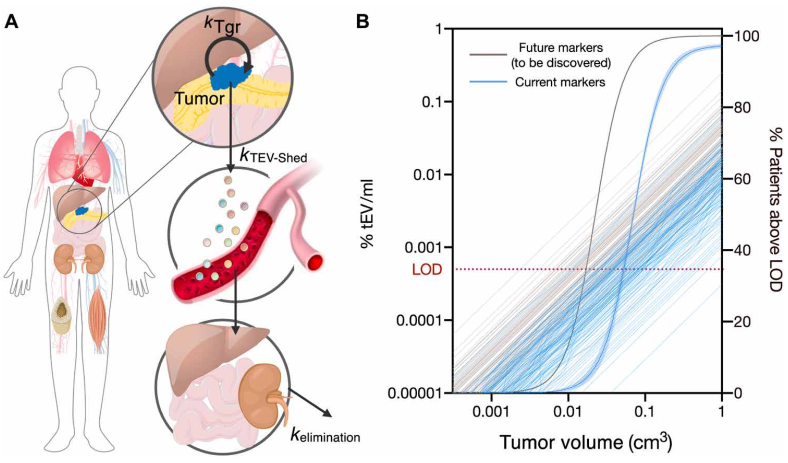
胰腺导管腺癌(PDAC)目前是癌症死亡的重要原因之一。治愈胰腺癌的唯一方法是在它仍然在局部时通过手术切除它。在目前的治疗模式下,只有20%的患者可手术,而40%的患者会出现局部但手术无法切除,而其余的40%的患者会出现转移。尽管有最先进的计算机断层扫描(CT)、磁共振成像(MRI)和超声内镜对“影像学发现的局部疾病”和接受手术的患者进行手术,但切缘的病理阳性率为40%至70%,并且胰周淋巴结病变病理阳性率为60%~80%。如果我们要治愈更多的胰腺癌患者,就需要新的诊断工具来识别患有临床前和真正局部疾病的患者,并探索新的治疗方法以允许更多的R0/N0切除。高分辨率、对比增强CT和MRI成像是常做的检查,但它们在检测微小疾病方面的敏感性通常受到限制,特别是在新辅助和术后环境中。技术进步继续快速提高检测血液样本中循环生物标志物的能力。这些“液体活检”标志物包括突变或甲基化无细胞DNA(cfDNA)、肿瘤相关细胞外囊泡(EV)、循环肿瘤细胞和代谢参数(例如,糖尿病和肌肉萎缩)。尽管EV、cfDNA和代谢标志物已经显示出用于PDAC诊断的前景,但它们目前的检测灵敏度需要进一步改进才能在临床上有用。特别是在疾病早期,较低的诊断准确性可能是由于PDAC的大量基质成分、与无肿瘤胰腺炎无法区分的胰腺炎局灶区域共存以及早期循环生物标志物数量少。研究人员已经开发了许多分析EV的方法。许多早期技术依赖于批量测量,单次测量需要102到106个EV。虽然单EV方法[用多荧光、单粒子干涉反射荧光成像、纳米粒子跟踪分析、微流体电阻脉冲传感和纳米流式细胞术进行单EV分析(sEVA)]正在积极开发中,但它们测量不同的参数(通常是大小而不是比分子生物标志物)。不管具体的物理测量如何,下一个问题是要分析哪种分子生物标志物。虽然研究仍在进行中,但很明显,许多描述的生物标志物在更大的临床验证队列中都失败了。因此出现的一个关键问题是,这种失败是否是由于选择了给定的分子生物标志物、PDAC的极端异质性,或者无法准确检测正常EV群体中极少量的生物标志物阳性EV。作者认为,解决当前问题的一种方法是进行sEVA,因为批量方法可能无法在宿主EV的背景下识别少量起源于肿瘤的EV(例如在微观癌症中发现的那些)。进一步假设突变的癌蛋白(例如,KRASmut)或肿瘤抑制基因(例如,P53mut)可以在单个EV中检测到,而癌细胞中发生的相同突变是肿瘤EV脱落增加的原因。检测这些突变蛋白质的选择也受到它们在PDAC发展级联中的早期出现的驱动。最后,作者推断可以通过对几种生物标志物进行多重测量来提高检测效率。在这些范例的基础上,开发并验证了一种强大的sEVA技术,该技术允许在单个EV中进行多重蛋白质测量。sEVA技术可解答如下问题:(i)EV中假定的癌细胞相关蛋白的固有异质性是什么,(ii)单个EV中突变的肿瘤/肿瘤抑制蛋白的频率是多少,以及(iii)单个EV上两种或多种癌症相关蛋白的表达水平是多少?通过非重叠标记“覆盖”更多肿瘤衍生的EV(tEV)或获得“高度特异性”的EV鉴定(如KRASmut和P53mut)是改善临床PDAC诊断的可靠选择。使用胰腺癌(PDAC),作者分析了11个细胞系中推定的癌症标志物的组成。在KRASmut和/或P53mut蛋白阳性的亲代PDAC细胞中,只有约40%的EV也是阳性的。在一项涉及16名经手术证实为1期PDAC患者的盲法研究中,可检测到KRASmut和P53mut蛋白的水平要低得多,通常在<0.1%的囊泡中(即,患者样本中阳性囊泡占比通常<0.1%)。16名患者中有15名可通过新的sEVA方法检测到这些囊泡。使用建模方法,作者估计基于单EV分析(sEVA)技术的PDAC检测限约为0.1-cm3肿瘤体积,优于临床成像能力。这些发现确立了sEVA用于早期癌症检测的潜力。FergusonS, Yang KS, Zelga P, Liss AS, Carlson JCT, Del Castillo CF, Weissleder R. Single-EVanalysis (sEVA) of mutated proteins allows detection of stage 1 pancreaticcancer. Sci Adv. 2022 Apr 22;8(16):eabm3453. doi:10.1126/sciadv.abm3453. Epub 2022 Apr 22. PMID: 35452280.外泌体资讯网 【Sci Adv】哈佛医学院:对单个细胞外囊泡进行突变蛋白分析可检测胰腺癌