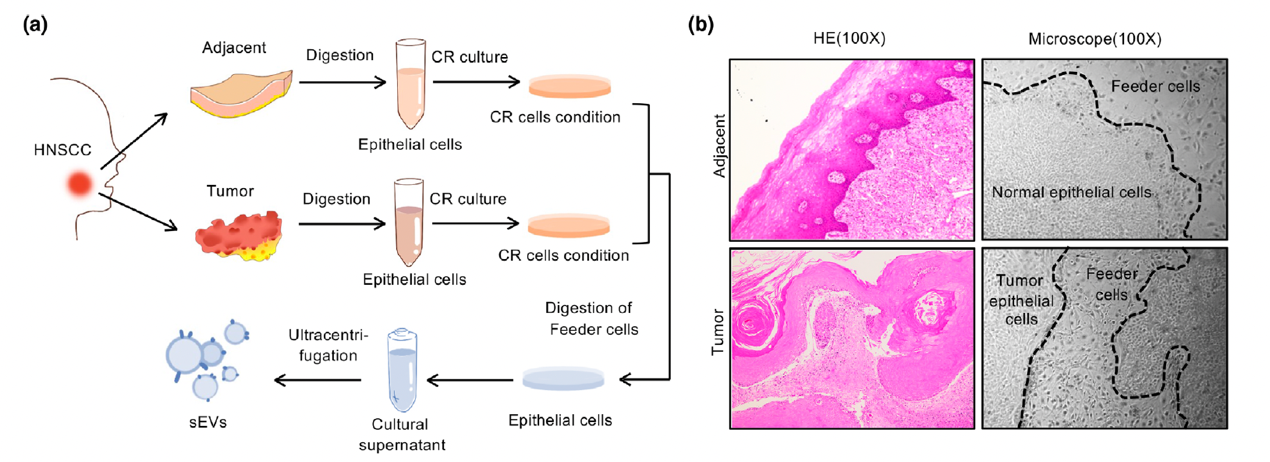
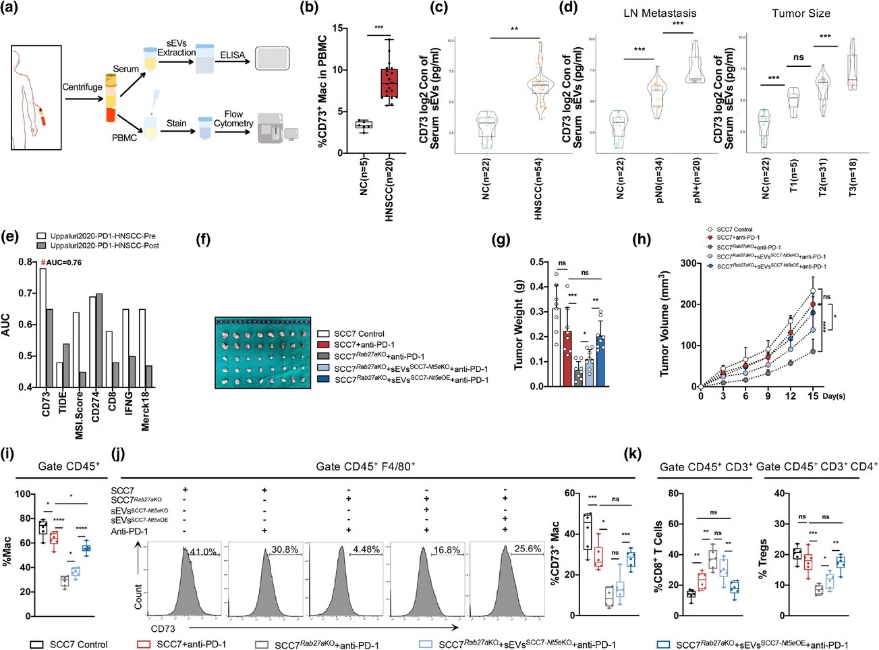
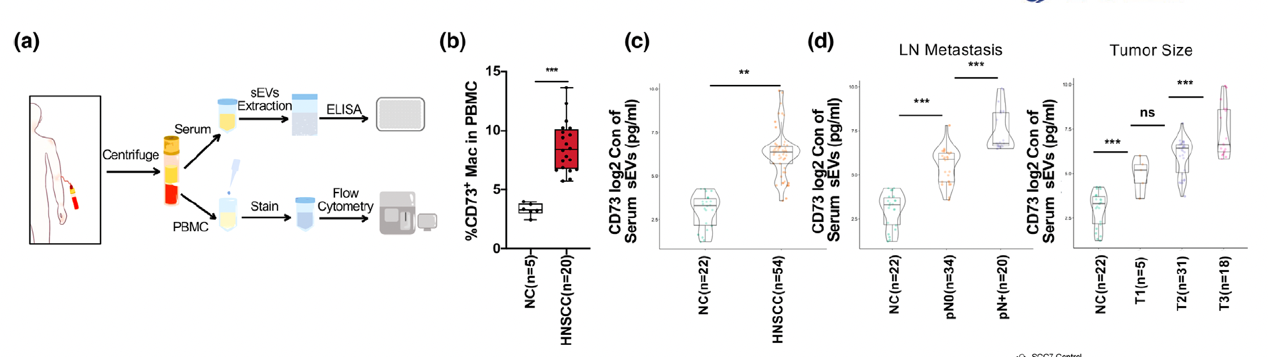
近年来,以抗PD-1药物为代表的免疫检查点阻断(ICB)治疗在肿瘤治疗领域获得了较好的效果。虽然抗PD-1治疗可以提高头颈鳞状细胞癌(HNSCC)的整体治疗效率,但只有15-20%的患者可有效响应治疗。因此,寻找新的联合治疗靶点,提高患者对抗PD-1治疗的敏感性的预测准确率,对HNSCC的治疗策略的制定具有重要的意义。近日,Journal of extracellular vesicles在线发表了上海交通大学医学院附属第九人民医院口腔颌面-头颈肿瘤外科严明/陈万涛团队的研究工作“CD73 in small extracellularvesicles derived from HNSCC defines tumor-associated immunosuppression mediatedby macrophages in the microenvironment” (2022 May;11(5):e1221)。该研究揭示了HNSCC分泌的小细胞外囊泡(sEVs)中CD73蛋白的表达对肿瘤微环境及抗PD-1治疗的影响,为提高免疫治疗的敏感性提供了新的思路及靶点。在该研究中,作者运用条件重编程细胞原代培养HNSCC组织结合蛋白质谱技术发现CD73在HNSCC源sEVs高表达,且与肿瘤淋巴结转移相关。在体内外实验中研究者证明HNSCC源sEVs中的CD73通过激活NF-κB通路诱导巨噬细胞向免疫抑制的表型分化,进一步影响巨噬细胞下游分子例如IL6, IL10, TNFA, TGFB1,LAG3, CD279和CD274的表达,削弱抗PD-1治疗的效果。同时体内实验证明,HNSCC源sEVsCD73的阻断能有效提高抗PD-1疗法的敏感性,公开发表的ICB数据集也证实CD73有作为HNSCC免疫治疗响应率预测标记物的潜力。图2HNSCC源sEVsCD73的阻断能有效提高抗PD-1疗法的敏感性另外,在肿瘤的无创诊断应用方面,该研究探索证实,患者血清sEVs中CD73的高表达,与HNSCC较高的淋巴结转移率和不良的疾病进展相关。可见sEVsCD73在基于液体活检的肿瘤早期诊断中具有良好的应用前景。图3CD73在HNSCC患者血清sEVs中高表达且与肿瘤进展相关综上所述,该研究通过体、内外实验证实了HNSCC通过 sEVsCD73远程调控巨噬细胞功能,并诱导免疫抑制而重塑肿瘤免疫微环境。揭示了sEVsCD73是头颈鳞癌免疫治疗中反应敏感性的潜在预测因子,也是ICB 的潜在组合靶点。 CD73 in smallextracellular vesicles derived from HNSCC defines tumour-associatedimmunosuppression mediated by macrophages in the microenvironment. J Extracell Vesicles. 2022 May;11(5):e12218. doi: 10.1002/jev2.12218.外泌体资讯网 JEV |上海交大医学院附属第九人民医院严明/陈万涛团队:HNSCC 源小细胞外囊泡CD73调控肿瘤相关巨噬细胞介导肿瘤免疫抑制