细胞外囊泡 (EV) 从癌细胞和宿主细胞中主动分泌到循环系统中,正在成为早期癌症检测、疾病监测和治疗评估的诊断领跑者之一。来自美国马萨诸塞州总医院系统生物学中心的研究人员在Trends in Molecular Medicine杂志上发表综述,概述了EV以及进行早期癌症检测的基本原理,研究了用于单个EV分析的新兴技术和在早期癌症检测中的必要性。
某个人是否患有会恶性生长并最终转移的癌症?这是社区医疗、肿瘤学、预防医学、医学流行病学和医疗保健成本界一直在努力解决的关键问题。众所周知,生长中的癌症会向循环中释放多种成分,包括整个细胞(即循环肿瘤细胞CTC)、肿瘤衍生DNA (ctDNA)、各种EV、蛋白质和代谢物。“液体活检”的前提是使用这些源自肿瘤细胞的成分进行诊断,而不用依赖于医学影像或肿瘤活检。目前,早期癌症诊断的关键问题是:哪种血液成分最适合检测;给定标记物的常见程度(稀有或超稀有);对于给定的癌症类型,该标记物的特异性如何?
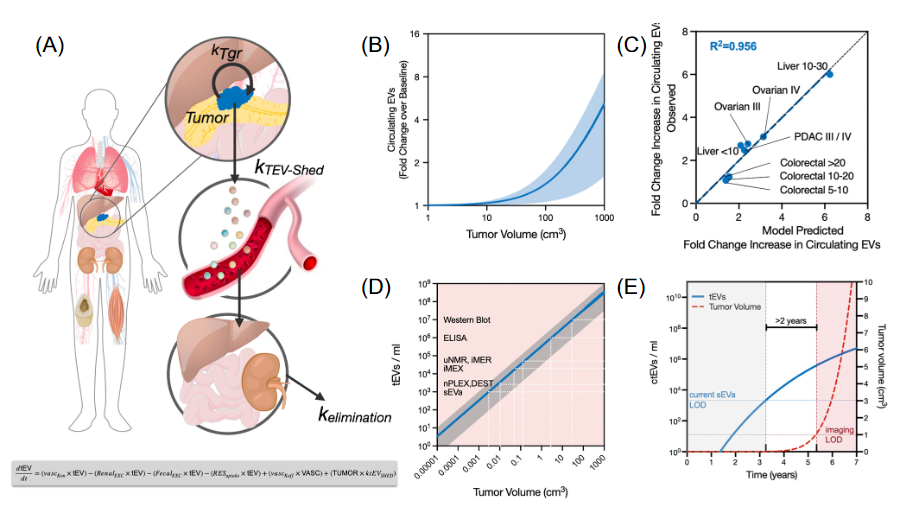
EV已成为早期癌症检测、疾病监测和治疗评估的诊断领跑者之一。EV 的优势在于囊泡通过分裂的肿瘤细胞不断脱落,有迹象表明肿瘤代谢率越高,EV 产量越高。脱落发生在活细胞中,这与ctDNA诊断不同,这种脱落不依赖于肿瘤细胞死亡。换句话说,EV的生产很可能是一个持续的事件,并且是癌细胞中最早出现的生物标志物来源之一。在晚期黑色素瘤中,发现突变等位基因BRAFV600E和cKITD816V的DNA与EV无关,但作者认为这在早期癌症患者中不适用。其他研究中对外泌体DNA与ctDNA的直接比较表明,外泌体 DNA在胰腺癌和肺癌中的突变检测方面优于ctDNA。此外,EV解决了一个使RNA和蛋白质无法更广泛使用的关键问题,可以保护货物在血液中不被降解。EV 还可以在囊泡内包装多种货物,以最终指示起源组织。
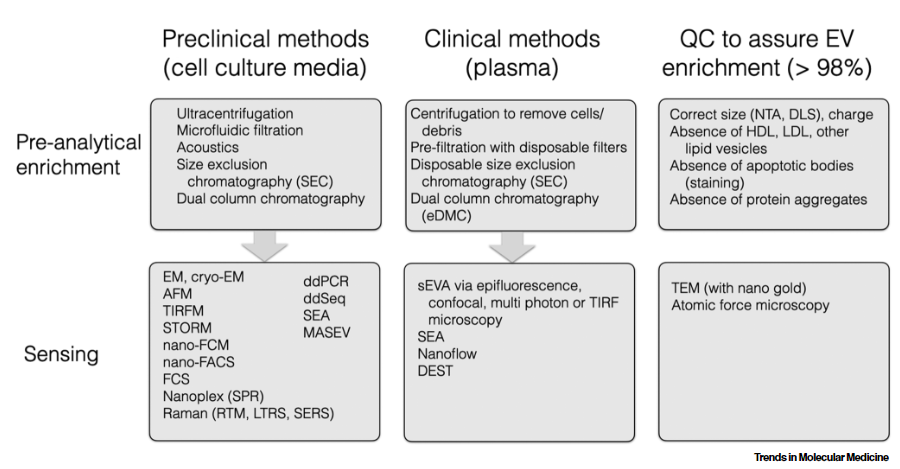
最近的研究表明,循环肿瘤衍生的EVs (ctEVs) 是异质的,只有少数EVs会携带肿瘤特异性生物标志物,如突变蛋白。要在大量宿主细胞衍生的EV中检测这些高度特异性但罕见的 ctEV,可能需要单个EV分析 (single EV analysis,sEVA)。在这篇综述中,作者重点介绍了 sEVA的最新进展,着眼于临床应用,讨论了当前的局限性以及进一步改进现有和新兴工具包所需的工作。
作者提到,晚期胰腺癌患者中约3%的EV和早期癌症患者中0.01%的EV中存在突变的 KRAS 蛋白、突变的P53和其他生物标志物。一项临床研究表明,约 90% 的 1 期 PDAC 患者可通过当前的sEVA方法检测到。随着临床上可行的单个EV检测技术的发展和进步,我们现在开始意识到ctEV的稀缺性和复杂性。目前仍有几个问题正在积极探索:(i)如何使现有的单个EV技术更加敏感;(ii) 是否可以开发多管齐下的策略来发现ctEV以识别其起源器官(以发现人体中的微小肿瘤);(iii) 我们能否从相对惰性(肿瘤在数年内增殖翻倍)与高度侵袭性(肿瘤在数月内增殖翻倍)癌症中识别和区分ctEV?我们预计sEVA的敏感性将随着未来更好的针对关键目标的抗体的出现而增加。其他改进领域包括更有效的预分析以避免稀有 ctEV 的损失、sEVA结合微流体以及更好的光学系统。虽然最近开发的数字微滴PCR (ddPCR) 和 ddEV-seq 方法可以采用,但这些方法复杂且耗时,需要进一步优化。另一种方法是对不同的EV 目标进行循环成像,例如,可以在单个EV中为20个生物标志物在五个周期内对四个通道(488 nm、535 nm、594 nm、647 nm)进行成像。
另一个具有相当大临床意义的领域是将sEVA与横断面成像相结合,以获得:(i) 空间定位目标;(ii) 提供时间信息;(iii) 能够更好地进行鉴别诊断。目前缺乏的是更好的诊断工具来对患者进行分层以获得最合适的治疗,避免与治疗相关的毒性,并变得具有成本效益。动态增强CT功能成像 (DCE-CT) 通常没有足够的准确性来实现这一点。sEVA 有可能通过整合EV生物标志物来改变现有的成像方法,以增强治疗监测和临床决策。然而,在这个领域还有很多工作要做。
总之,sEVA 是一个令人兴奋的新研究领域,它将阐明循环EV的生物学,希望新兴的临床试验可用于各种不同恶性肿瘤的早期检测。