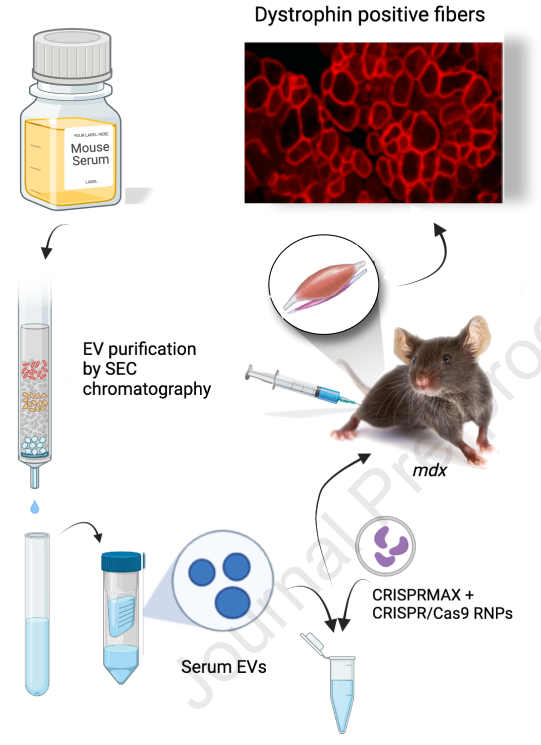
细胞外囊泡(EV)介导体内细胞间生物分子交换,使其成为治疗性货物的有前途的运载工具。CRISPR系统的基因工程是治疗杜氏肌营养不良症(DMD)等遗传疾病的有趣途径。近日,Molecular Therapy杂志上的一篇文章报道发现利用血清的细胞外囊泡递送CRISPR-Cas9核糖核蛋白,修改抗肌萎缩蛋白(dystrophin)基因,允许dystrophin在肌纤维中表达。这种方法为快速、安全地递送CRISPR成分来治疗DMD开辟了新的机会。
杜氏肌营养不良(DMD)是一种遗传性疾病,由DMD基因的各种突变引起,这些突变会损害抗肌萎缩蛋白(dystrophin)的表达。大约70%的患者有一个或多个外显子缺失导致移码突变。其他30%有无义点突变。目前正在研究针对这种疾病的各种治疗方法。
目前只有外显子跳跃被批准商业化。该技术使用针对剪接受体或剪接供体位点的反义寡核苷酸(ASO)从最终mRNA中去除患者缺失之前或之后的外显子。这种治疗可以恢复抗肌萎缩蛋白的表达,但不一定能恢复其全部活性。事实上,肌营养不良蛋白的中心部分由24个血影蛋白样重复(SLR)组成,其起点和终点与外显子跨度不匹配。因此,取决于被删除的外显子,SLR结构或多或少是正常的,这可能导致严重贝克尔患者的表型。
正在研究的另一种方法是使用编码微肌营养不良蛋白的AAV。经过多年的研究,已经产生了各种微肌营养不良蛋白基因,并在小鼠和狗身上显示出令人鼓舞的结果。然而,一名年轻的DMD患者在使用微量肌营养不良蛋白治疗的临床试验期间意外死亡,导致该临床试验的暂停。
通过CRISPR-Cas9技术进行基因编辑已显示出纠正或绕过DMD突变的有希望的结果:DMD小鼠胫骨前肌(TA)肌肉中的抗肌萎缩蛋白表达已通过在DMD基因中单次切割CRISPR-Cas9以触发外显子跳跃而得到拯救,并通过双切割删除突变并创建杂合外显子。使用CRISPR碱基编辑在DMD基因中进行核苷酸替换也成功地恢复了DMD模型中的肌营养不良蛋白表达。大多数体内CRISPR编辑的递送方法都涉及AAV。然而,在临床试验期间,AAV已被证明会引起许多不利影响,例如对人类的肝毒性、神经和血液学影响。此外,先前暴露于天然存在的AAV的现有抗体以及这种治疗的高昂成本,可能阻碍了患者接受基于AAV的治疗。
最近,已开发出基于细胞外囊泡(EV)的系统以在体内递送CRISPR-Cas9。EV由所有类型的细胞产生,可以跨越生物屏障并避开单核吞噬系统,这些特性使它们成为有前途的药物输送载体。CRISPR核糖核蛋白复合物(RNP)在转染转基因Cas9基因后成功包装在源自HEK293T的EV中,该基因与对EV货物具有高亲和力的蛋白质结构域融合。使用超声处理将RNP体外包装到已经纯化的HEK293T衍生EV中也很成功。使用EV传递CRISPR系统的活性剂的一大优势是它们允许传递Cas9蛋白而不是Cas9基因,这避免了其持续表达,从而降低了免疫反应和脱靶突变的产生。然而,癌细胞衍生的EV的使用引发了人类治疗的安全问题,因为它们携带可能与RNP共同递送的潜在致癌物质。
该研究证明,可以使用从血清中纯化的EV来传递SpCas9蛋白和2个gRNAs来删除有问题的外显子,而不是使用AAV或HEK293T衍生的EV。血清EV已显示出再生治疗的巨大潜力,特别是在营养不良小鼠中恢复膜完整性和肌肉功能。与其他方法相比,血清EV为CRISPR递送提供了一个安全且具有成本效益的高效平台。
该研究开发了一种简单的方法,用EV装载由SpCas9蛋白和引导RNA(gRNA)组成的CRISPR核糖核蛋白(RNP)。首先使用超滤和尺寸排阻色谱法从人或小鼠血清中纯化EV。使用蛋白质转染剂将RNPs加载到血清EVs中,研究发现EVs在体外是RNPs的良好载体,并恢复了tdTomato荧光蛋白在Ai9小鼠肌肉纤维中的表达。携带靶向DMD基因内含子22和24的RNP的EV被注射到在外显子23中具有无义突变的mdx小鼠的肌肉中。从处理过的mdx小鼠中提取的多达19%的cDNA具有预期的外显子23和24缺失,允许肌营养不良蛋白在肌纤维中表达。这种方法为快速、安全地递送CRISPR成分来治疗DMD开辟了新的机会。
参考文献:
Majeau N, Fortin-Archambault A, Gérard C, Rousseau J, Yamégo P, Tremblay JP. SERUM EXTRACELLULAR VESICLES FOR DELIVERY OF CRISPR-CAS9 RIBONUCLEOPROTEINS TO MODIFY THE DYSTROPHIN GENE. Mol Ther. 2022 May 25:S1525-0016(22)00321-5. doi: 10.1016/j.ymthe.2022.05.023. PMID: 35619556.