肺癌是仅次于乳腺癌的高发恶性肿瘤,也是全球癌症死亡的首要原因。为了克服影像学筛查在早期诊断中的技术局限性,液体活检已经成为肺癌诊断领域中备受关注的发展新方向,而肺癌外泌体正是其中颇具潜力的循环生物标志物之一。因此,研发灵敏且特异的肺癌外泌体分析新方法对于提高肺癌早期诊断的准确性和及时性具有重要的意义。
近日,上海大学赵婧教授团队提出了一种由程序化DNA反应赋能的肺癌外泌体电化学检测新方法,通过整合引物交换反应(PER)和CRISPR-Cas反式切割反应的级联信号放大,为PD-L1阳性肺癌外泌体的高灵敏定量分析提供了思路。该成果近期作为内封面文章发表在Analytical Chemistry,题目为“Programmable DNA-Fueled Electrochemical Analysis of Lung Cancer Exosomes” (doi:10.1021/acs.analchem.2c01318)。上海大学曹亚高级实验师和赵婧教授为论文的共同通讯作者,硕士生沙玲君为论文第一作者。
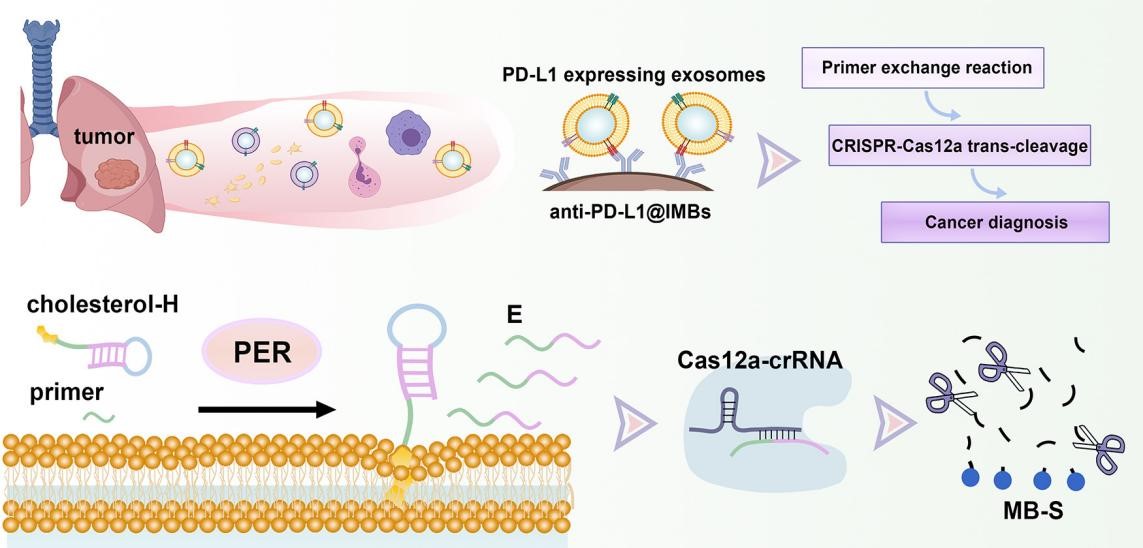
在该研究中,PD-L1阳性的肺癌外泌体被PD-L1抗体功能化的磁珠捕获并结合胆固醇功能化的催化发夹DNA,引发级联信号放大反应(图1)。级联信号放大反应从催化发夹DNA触发的引物交换反应开始,其产生的大量延伸产物可以进一步激活Cas12a蛋白的反式切割活性。随后,Cas12a催化的随机切割反应促发了亚甲基蓝标记的DNA信号链降解,从而释放了其末端具有电活性的亚甲基蓝分子。最后,游离的亚甲基蓝被富集到葫芦[7]脲功能化的石墨电极表面,产生适用于PD-L1阳性肺癌外泌体定量分析的电化学信号。
图1程序化DNA反应赋能的PD-L1阳性肺癌外泌体电化学分析的原理示意图
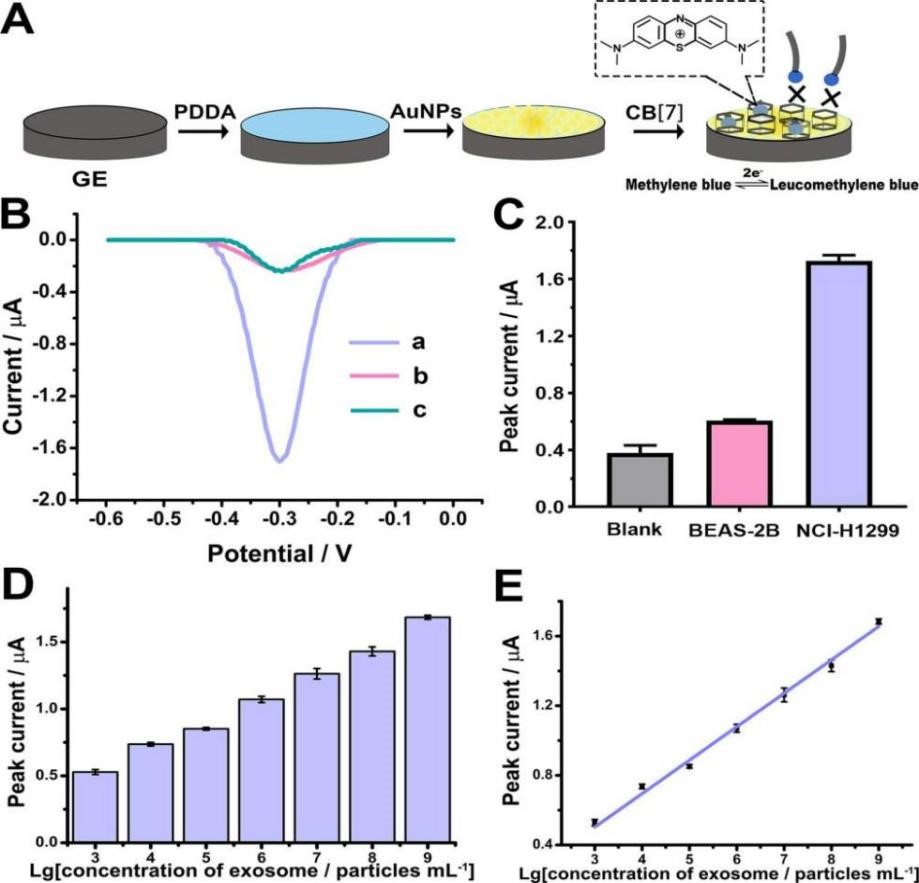
图2程序化DNA反应赋能的肺癌外泌体电化学分析结果图
图2A描述了葫芦[7]脲功能化电极制备以及富集亚甲基蓝分子进行电化学分析的原理。如图2B所示,当存在PD-L1阳性肺癌外泌体时,引物交换反应触发CRISPR-Cas12a催化的DNA降解反应后,电极表面可以观察到较高的电化学信号响应(曲线a)。相比之下,在没有PD-L1阳性肺癌外泌体存在(曲线b)或存在PD-L1阳性肺癌外泌体但没有Cas12a蛋白(曲线c)的情况下,只能检测到相当低的电化学信号。这是因为,在没有PD-L1阳性肺癌外泌体或未经Cas12a降解的情况下,长DNA链与葫芦[7]脲之间存在静电排斥,亚甲基蓝分子不能接近功能化的石墨电极。同时,将该方法用于NCI-H1299细胞分泌的PD-L1阳性外泌体检测时,可以得到较高的峰电流值且峰电流值随着外泌体浓度的增加而增加,检测范围为103至109个外泌体/毫升,检测限为708个外泌体/毫升。但是,当用于正常细胞BEAS-2B分泌的外泌体检测时,该方法仅能得到很低的峰值电流(图2C和D)。由此可见,该方法不仅可以特异性地区分PD-L1阳性肺癌外泌体,而且还具有令人满意的检测灵敏性。
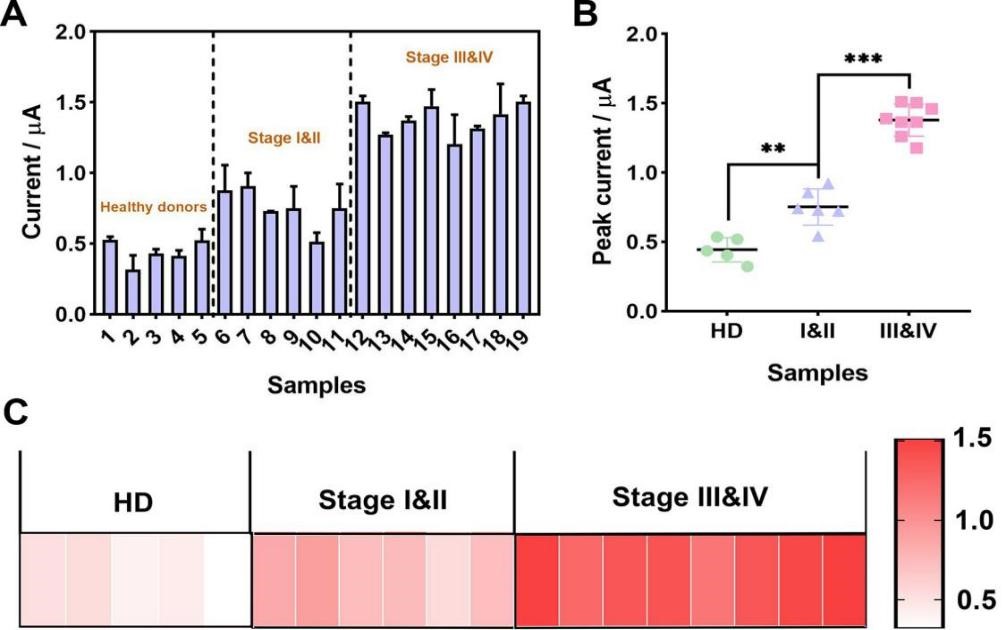
图3临床样品的电化学分析结果图
此外,该方法还被用于肺癌患者的临床血清样本分析(图3)。在健康志愿者的血清样品中,我们仅能检测到与背景几乎相同的低峰值电流,而在非小细胞肺癌患者的血清样品中,可以检测到较强的峰值电流,同时,峰电流强度与肺癌患者病程进展存在正相关性。由此可见,该方法不仅可以为肺癌的早期诊断提供更为精确的预警信息,而且还有利于病程和治疗效果的动态监测,因而为肺癌的诊断、治疗以及预后提供了技术支持。
参考文献:
Programmable DNA-Fueled Electrochemical Analysis of Lung Cancer Exosomes, Anal Chem. 2022 June 1. doi: 10.1021/acs.analchem.2c01318.