骨髓间充质干细胞(BMSCs)是存在于哺乳动物的骨髓基质中,具有多种分化潜能的细胞亚群。其能通过多种途径分泌各种细胞因子并修复受损器官,涉及抗炎、血管保护及免疫调节等多种机制。此外,BMSCs分泌的细胞外囊泡(BMSC-EVs)内含脂质,miRNA,DNA等多种小分子,在细胞间的沟通中起到重要作用,因而其在众多疾病中的潜在治疗作用受到越来越多的关注。已有研究表明BMSC-EVs能够缓解环孢素诱导的肾纤维化,表现为TGF-β1表达减少以及小管上皮细胞向间充质细胞转化(EMT)减少。然而,关于BMSC-EVs缓解肾纤维化的深层机制仍然有待进一步研究及阐明。
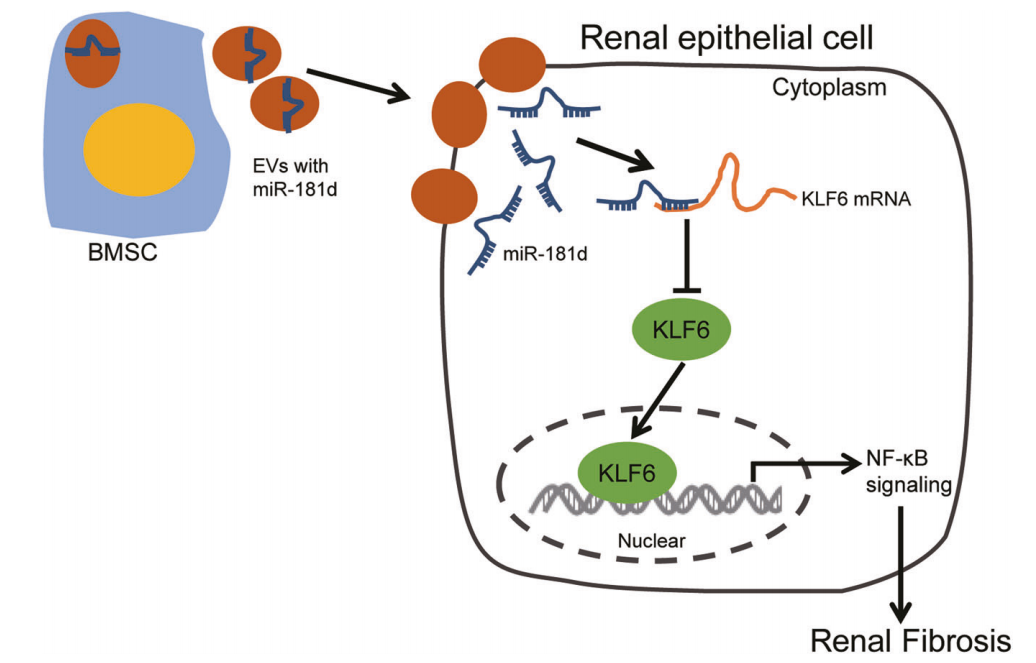
近日,浙江大学医学院附属第四医院(暨浙江大学国际健康医学研究院、浙江大学“一带一路”国际医学院)周浩团队在Cell Death & Disease杂志上发表了题为“Bone marrow mesenchymal stem cell-derived extracellular vesicles containing miR-181d protect rats against renal fibrosis by inhibiting KLF6 and the NF-κB signaling pathway” (2022 Jun 7;13(6):535)的研究。该研究发现BMSC-EVs中携带的miR-181d能够通过下调KLF6基因的表达,从而抑制NF-κB信号通路的激活,最终缓解了肾纤维化疾病的进展。该研究进一步揭示了BMSC-EVs作用于肾纤维化的部分深层机制。
该团队首先是以高表达CD29、CD44和CD73,低表达HLA-DR为标准筛选出BMSCs,再从中提取出BMSC-EVs用于后续实验。
在分子水平上,研究者运用生物信息学技术预测了BMSC-EVs中富集的miR-181d与KLF6 mRNA的结合位点。KLF6作为一种 DNA 结合蛋白,对基因的转录具有调控作用。进一步研究发现,HK-2细胞中KLF6的抑制,能够降低细胞内p-IκBα的含量,进而阻碍了NF-κB信号通路的激活,最终缓解了肾纤维化程度,表现为免疫蛋白印迹,RT-qPCR检测HK-2细胞中Col4α1,α-SMA等指标水平均下降。
而在组织水平上,研究者发现miR-181d在肾纤维化组织中的含量显著低于正常组织。而KLF6和NF-κB则恰好相反,在肾纤维化组织中的含量高于正常组织中的含量。Masson染色和天狼星染色显示,使用了miR-181d-agomir处理后,间质内的细胞外基质沉积显著减少。以上结果均表明,肾纤维化发展与BMSC-EVs中的miR-181d含量呈反比,而与KLF6和NF-κB的表达量呈正比。
图. BMSC-EVs通过调节miR-181d/KLF6/NF-κB轴对肾纤维化的影响
该研究揭示了BMSC-EVs中富含的miR-181d通过靶向抑制KLF6,进而使NF-κB信号通路失活,延缓了肾纤维化的进展。该研究为未来开发新的肾纤维化治疗方式提供了新的思路和部分理论基础。
参考文献:
Bone marrow mesenchymal stem cell-derived extracellular vesicles containing miR-181d protect rats against renal fibrosis by inhibiting KLF6 and the NF-κB signaling pathway. Cell Death Dis. 2022 Jun 7;13(6):535. doi:10.1038/s41419-022-04875-w.
(储非凡、陈卢敏撰稿)
外泌体资讯网 Cell Death Dis | 浙大四院周浩团队发现骨髓间充质干细胞来源的细胞外囊泡作用于肾纤维化的新机制