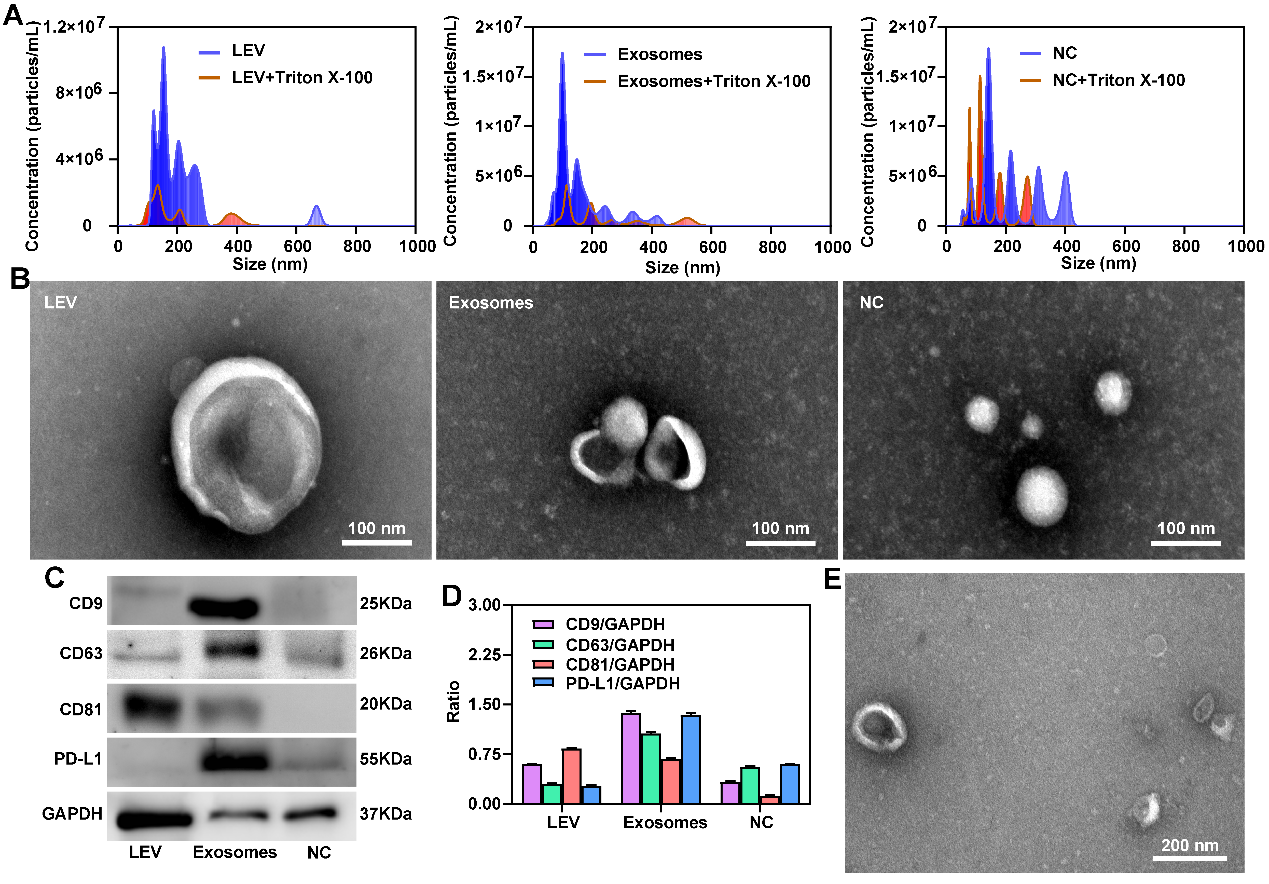
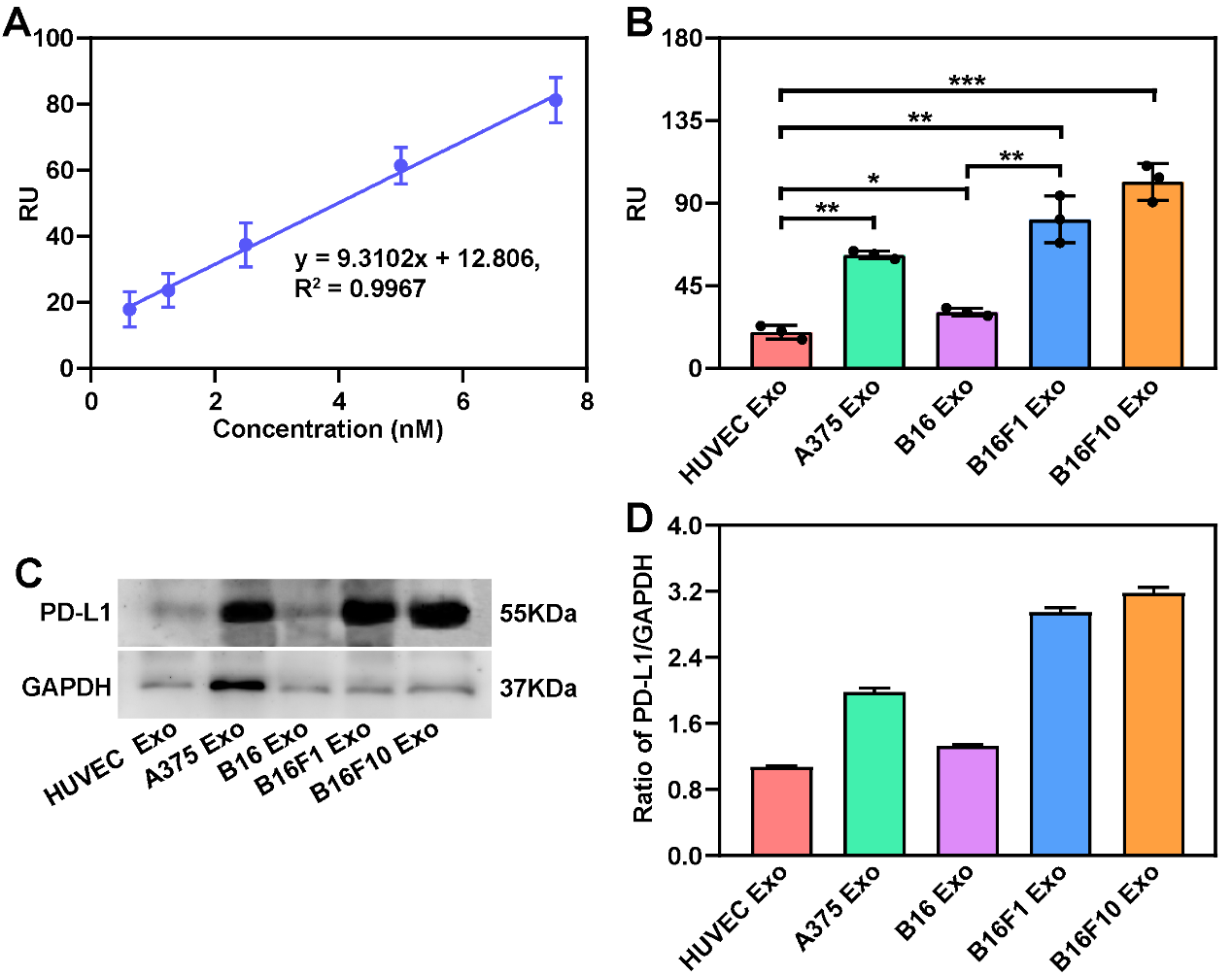
外泌体是细胞分泌的直径为 30~150 nm 的细胞外囊泡,广泛分布于各种体液中,携带与其母细胞相关的蛋白、脂质和核酸等生物信息,能够稳定存在于血液循环中,是一种新兴的液体活检生物标志物。然而由于外泌体尺寸小,从复杂培养基中分离并检测外泌体仍然是一个挑战。近日,郑州大学药学院张振中教授和张红岭教授团队在Nanoscale杂志上发表题为“Isolation of circulating exosomes and identification of exosomal PD-L1 for predicting immunotherapy response”的研究论文(DOI: 10.1039/D2NR00829G)。这项研究使用碘克沙醇密度梯度离心法分离和纯化外泌体,并通过基于表面等离子共振(surface plasmon resonance,SPR)的生物芯片检测外泌体 PD-L1,将该方法命名为SPR-ExoPD-L1。结果表明提取的外泌体是脂质双层膜结构的囊泡,外泌体标志蛋白CD9、CD63和CD81在提取的外泌体中高度富集。此外,PD-L1 特异性表达在外泌体上,而不是非囊泡成分或大的细胞外囊泡上。与酶联免疫吸附试验相比,该方法能更好地区分PD-L1表达水平不同的黑色素瘤细胞来源的外泌体,可为外泌体作为液体活检标志物用于临床癌症免疫疗效评估提供一种新策略。

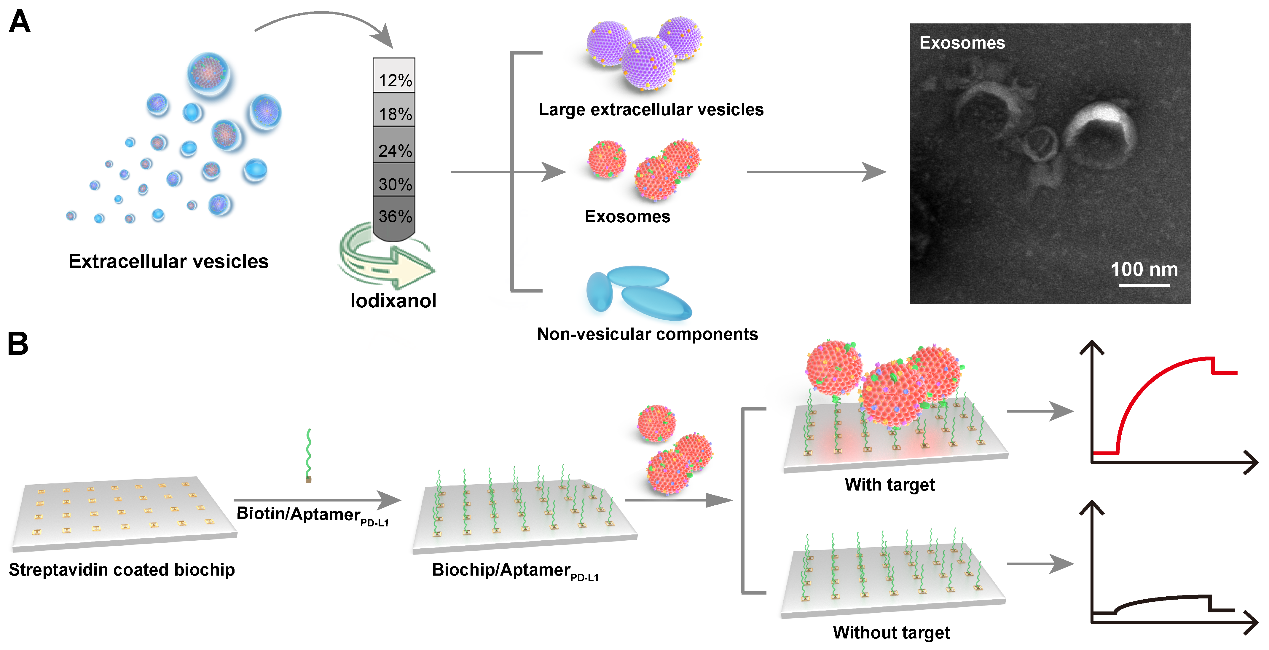
图1. 细胞外囊泡分离和外泌体PD-L1检测原理示意图
图2. 表征大的细胞外囊泡(LEV)、外泌体(exosomes)和非囊泡成分(NC)
图3. SPR-ExoPD-L1检测不同细胞来源外泌体的 PD-L1 表达水平
郑州大学副研究员张俊利为文章第一作者,张振中教授和张红岭教授为文章共同通讯作者。该工作受到国家自然科学基金(82073787和 82173784)的支持。参考文献:Isolation of circulating exosomes and identification of exosomal PD-L1 for predicting immunotherapy response, Nanoscale, 2022, DOI: 10.1039/D2NR00829G.
外泌体资讯网 Nanoscale |郑州大学张振中教授和张红岭教授团队:循环外泌体的分离及其PD-L1蛋白水平预测免疫应答