细胞外囊泡(extracellular vesicles, EVs)是一种由细胞释放到细胞外基质的膜性小囊泡,它广泛存在于循环系统和各种体液中,是一种重要的细胞间通信媒介。非编码RNA(ncRNA)是一类在RNA水平上调控基因组转录并影响相应生物学功能,但最终不翻译成蛋白的RNA,通常包括微RNA (miRNA)、长链非编码RNA(lncRNA)和环状RNA(circRNA)等,既往被认为是“转录噪音”而并未得到重视。
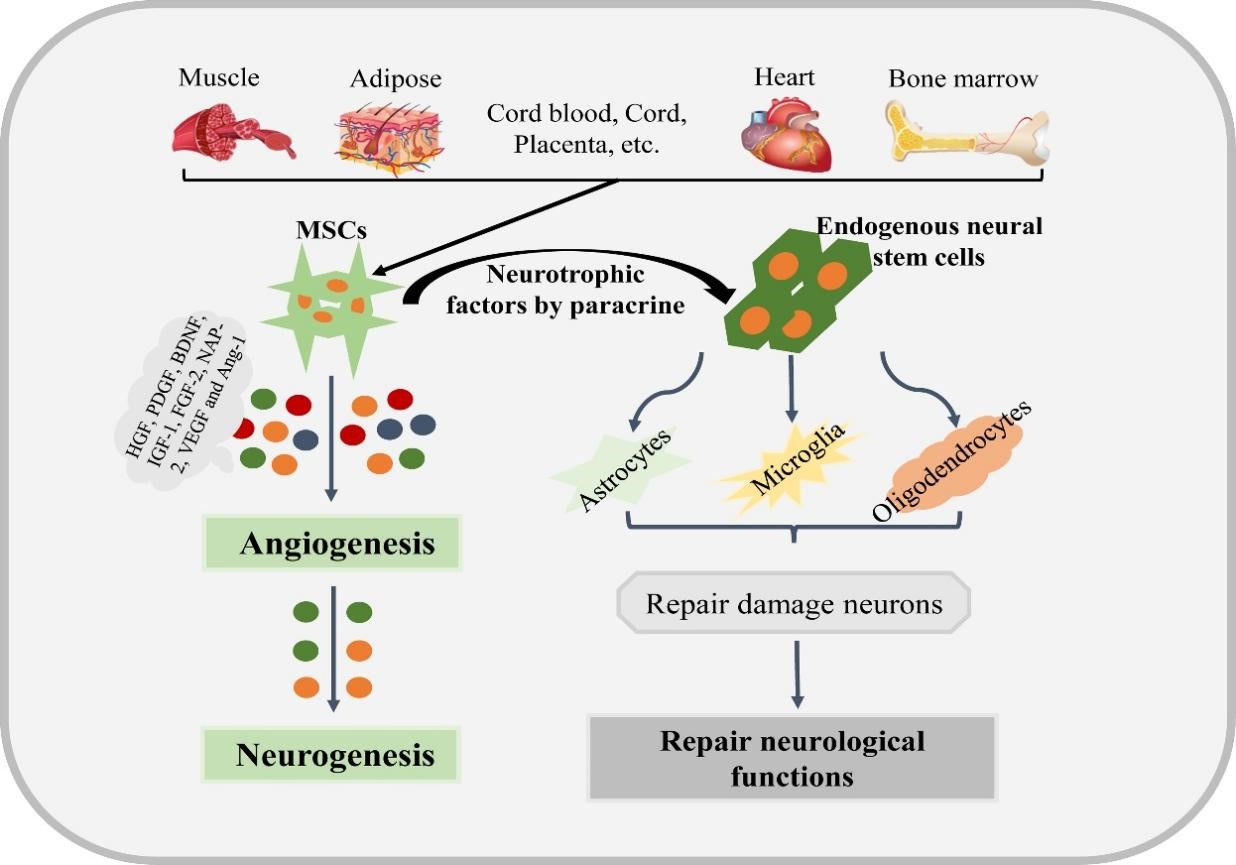
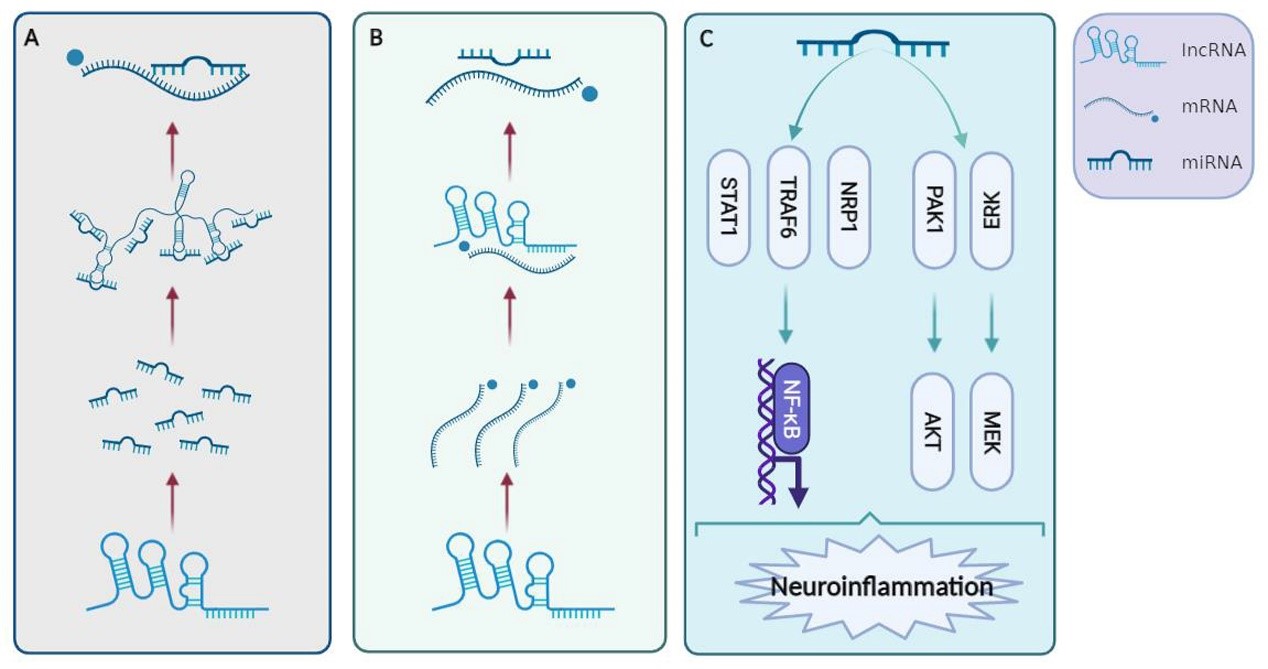
随着对二者的深入研究,目前认为,EVs和ncRNA调控并参与多种神经系统疾病的病理生理过程,如细胞的增殖、凋亡,自噬,神经再生,血管再生,神经炎症等[1, 2]。作者以神经炎症为例,指出间充质干细胞和内源性神经干细胞分泌的EVs通过细胞因子、神经营养因子、转录因子和miRNAs等多种信号通路调控缺血性卒中条件下的小胶质细胞的激活与极化,最终促进神经元再生与修复[3]。(图一)目前研究表明,神经炎症通常会导致大量ncRNA的异常表达,这些ncRNA在基因表达的表观遗传和转录调控中发挥重要作用。ncRNA可以通过与不同的信号通路相互作用来调节炎症反应,这可能是中风治疗一个新的潜在治疗靶点。作者指出ncRNA一方面可以直接调节炎症反应,另一方面也可以通过调节小胶质细胞的激活和极化间接参与炎症调节。既往研究认为lncRNA-miRNA-mRNA轴在炎症调节中起关键作用 [2], (图二)作者以lncRNA NEAT1为代表,通过NEAT1-miRNA-mRNA作用轴的形式,NEAT1既直接参与中枢神经系统和外周系统的炎症调节,又可以抑制小胶质细胞的激活和脂质积累间接调节炎症反应[4]。
(图一)
(图二)
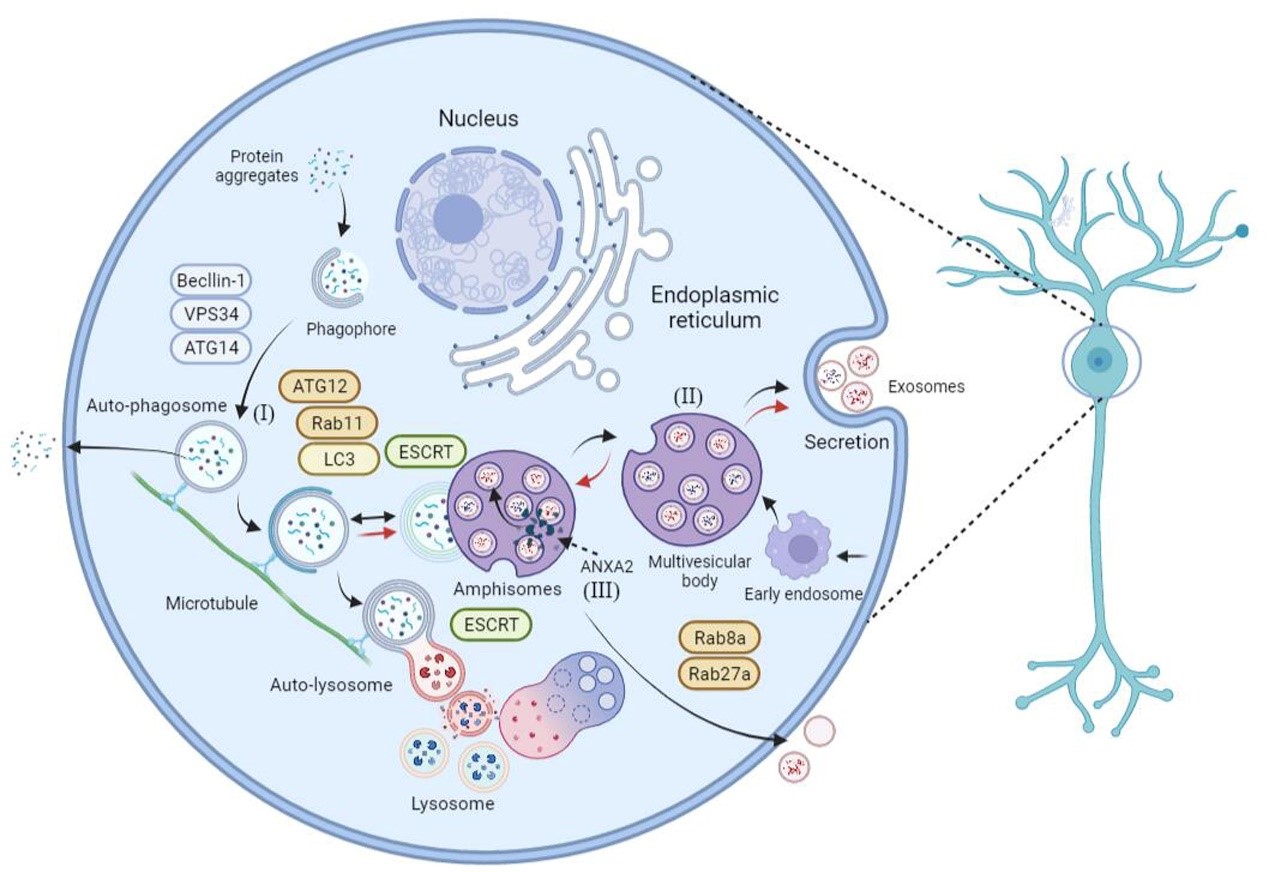
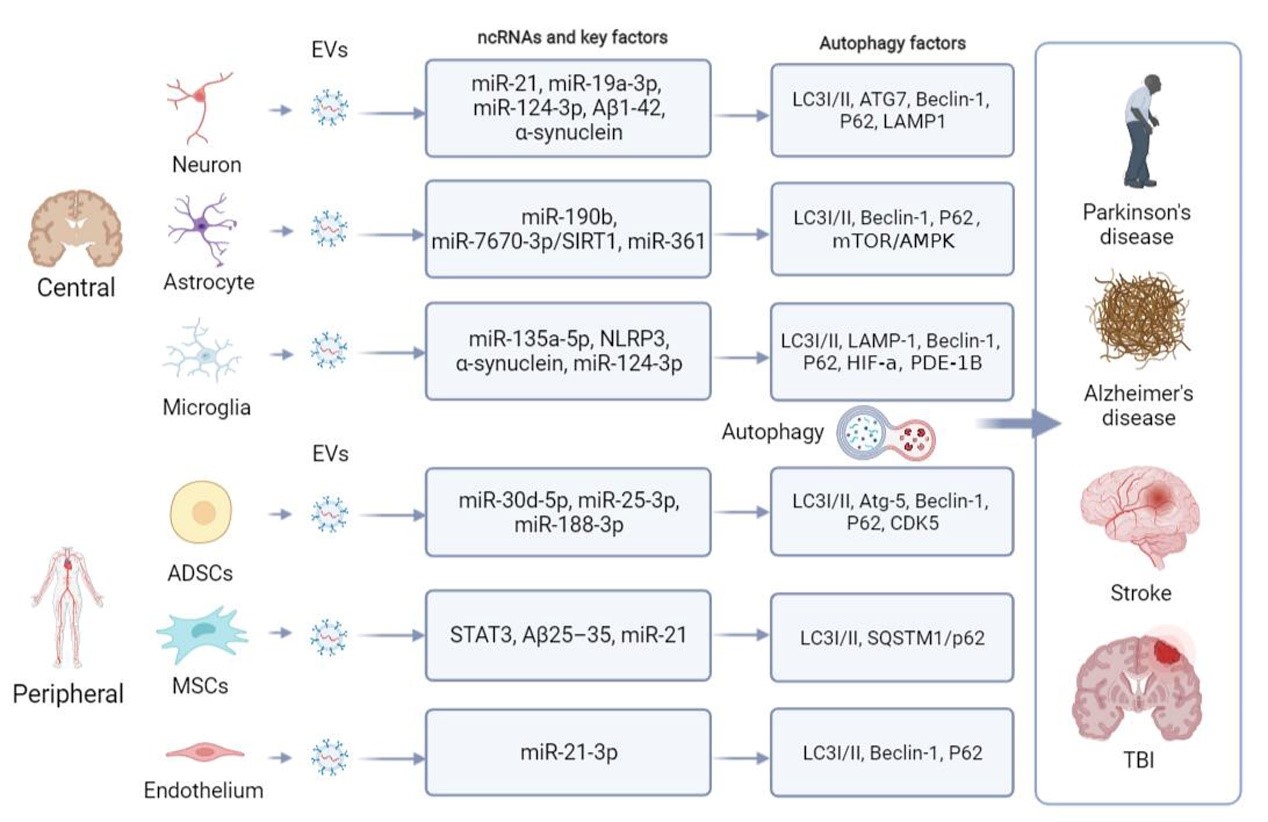
另外,自噬作为一种细胞内降解过程,与EVs一样参与神经系统疾病的病理生理过程。目前研究认为,EVs的生物发生与自噬相关,而自噬也受到EVs的调控,即EVs与自噬存在相互作用。一方面,靶细胞的自噬水平本身可以调控EVs的分泌以及成分,并参与EVs的运输(图三)。另一方面,EVs可以将其载物ncRNA释放到靶细胞中,进而直接通过调节自噬相关蛋白或者调控ncRNA间接调控靶细胞的自噬水平(图四) [5]。因此,EVs通过调节自噬,如抑制过度自噬导致的细胞损伤,为神经系统疾病的辅助治疗提供了很大的机会,有潜力成为未来的神经系统疾病治疗一个很好的新靶点。
(图三)
(图四)
目前关于EVs作用机制的研究中发现,EVs作为一个载体可以携带多种具有生物活性的内含物,非编码RNA就是其中最主要的一种内容物,而这些内含物的分拣是一个受调控的、非随机的过程。在细胞中,通过鞘磷脂酶2依赖途径,miRNA的固有结构(3'端腺苷化和尿苷化),hnRNP依赖的苏氨酸化分选途径,miRISC相关通路和RNA结合蛋白等途径将 ncRNA装载到EVs中,进而受体细胞可以通过直接融合、受体介导的融合和内吞作用三种途径摄取来自EVs的ncRNA,进而调控下游多种mRNA的转录(图五) [6] 。
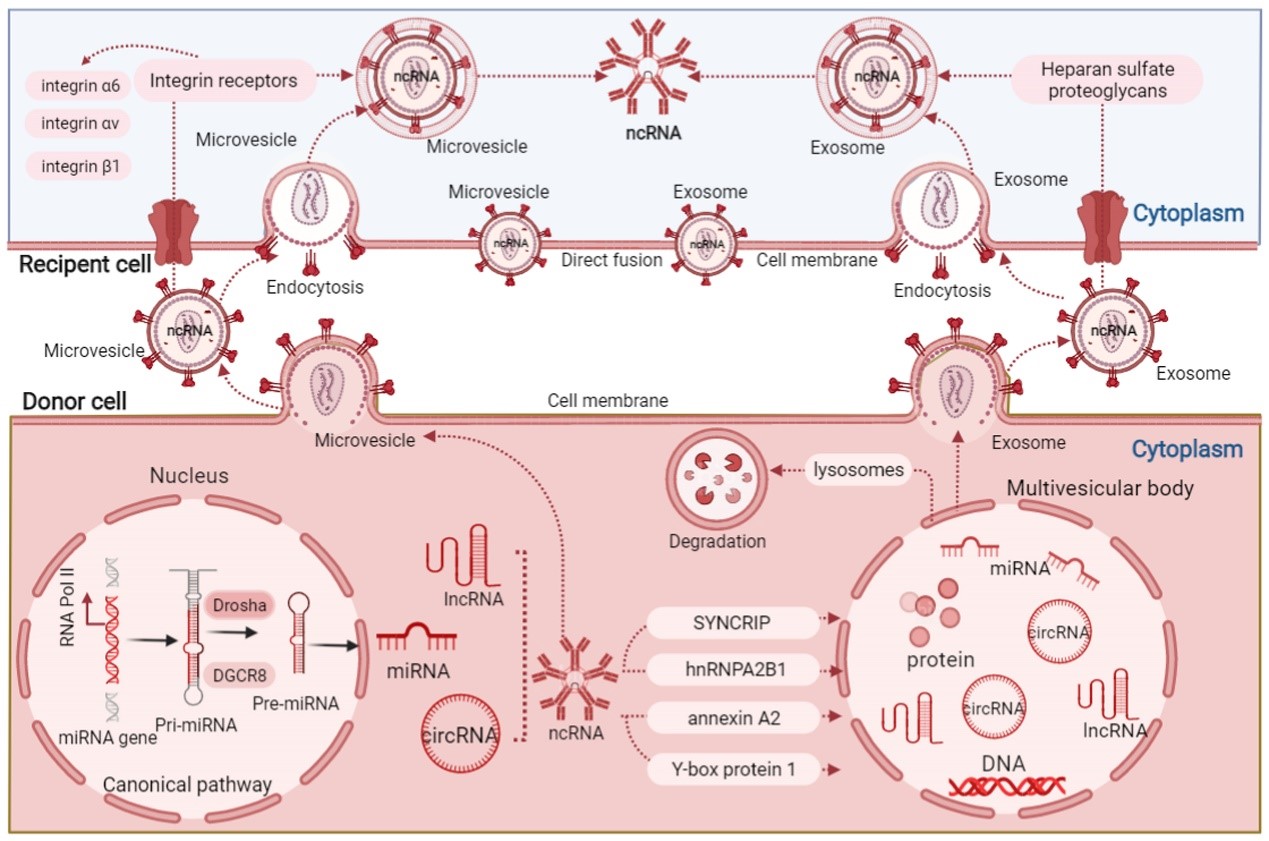
(图五)
参考文献:1. Pan Y, Jiao Q, Wei W, Zheng T, Yang X, Xin W. Emerging Role of LncRNAs in Ischemic Stroke-Novel Insights into the Regulation of Inflammation. Journal of inflammation research. 2021;14:4467-83. doi: 10.2147/jir.S327291. PubMed PMID: 34522116.
- Li F, Kang X, Xin W, Li X. The Emerging Role of Extracellular Vesicle Derived From Neurons/Neurogliocytes in Central Nervous System Diseases: Novel Insights Into Ischemic Stroke. Frontiers in pharmacology. 2022;13:890698. doi: 10.3389/fphar.2022.890698. PubMed PMID: 35559228.
- Xin W, Wei W, Pan Y, Cui B, Yang X, Bähr M, et al. Modulating poststroke inflammatory mechanisms: Novel aspects of mesenchymal stem cells, extracellular vesicles and microglia. World journal of stem cells. 2021;13(8):1030-48. doi: 10.4252/wjsc.v13.i8.1030. PubMed PMID: 34567423.
- Pan Y, Wang T, Zhao Z, Wei W, Yang X, Wang X, et al. Novel Insights into the Emerging Role of Neat1 and Its Effects Downstream in the Regulation of Inflammation. Journal of inflammation research. 2022;15:557-71. doi: 10.2147/jir.S338162. PubMed PMID: 35115805.
- Wei W, Pan Y, Yang X, Chen Z, Heng Y, Yang B, Pu M, Zuo J, Lai Z, Tang Y, Xin W. The Emerging Role of the Interaction of Extracellular Vesicle and Autophagy-Novel Insights into Neurological Disorders. J Inflamm Res. 2022 Jun 9;15:3395-3407. doi: 10.2147/JIR.S362865. PMID: 35706531; PMCID: PMC9191200.
- Dirk M. Hermann, Wenqiang Xin, Mathias Bähr, Bernd Giebel, and Thorsten R. Doeppner.
Emerging roles of extracellular vesicle-associated non-coding RNAs in hypoxia: Insights
from cancer, myocardial infarction and ischemic stroke. Theranostics; In press.