在各种消化系统恶性肿瘤之中,结直肠癌(Colorectal cancer,CRC)的发病率及死亡率最高,死亡率居恶性肿瘤致死率第四位,大量患者患有晚期/转移性肿瘤,5年生存率低于20%。抗血管生成治疗是转移性结直肠癌(Metastatic colorectal cancer mCRC)的重要治疗策略。阿帕替尼是血管内皮细胞生长因子受体2 (VEGFR-2)的高选择性口服抑制剂,是一种有潜力的多药耐药性逆转剂。阿帕替尼目前在中国被批准用于治疗晚期胃癌和肝细胞癌。除了血管生成抑制外,一些新的调节机制的发现强调了阿帕替尼在CRC治疗中的抗肿瘤作用。
近日,厦门大学医学院胡天惠教授团队在Cancers在线发表题为“Studies of the Efficacy of Low-Dose Apatinib Monotherapy as Third-Line Treatment in Patients with Metastatic Colorectal Cancer and Apatinib’s Novel Anticancer Effect by Inhibiting Tumor-Derived Exosome Secretion”的文章(2022 May; 14(10): 2492.),评估了低剂量阿帕替尼单药治疗作为转移性结直肠癌患者三线治疗的疗效和安全性,还揭示了阿帕替尼抑制肿瘤外泌体释放的新型抗癌机制。
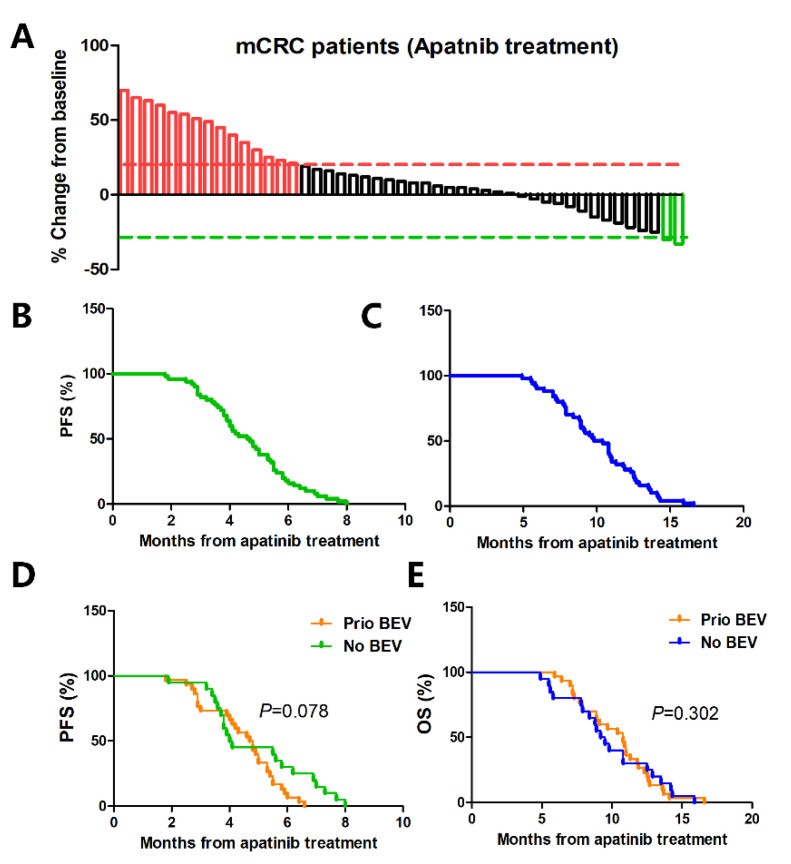
在这项研究中,50例患者均口服250 mg阿帕替尼,1次/d,ORR和DCR分别为4.0%(2/50)和70%(35/50),中位PFS和OS分别为4.7个月和10.1个月,结果显示了患者生活质量的显著改善以及可耐受的不良反应。低剂量阿帕替尼治疗的毒性通常耐受性良好,可通过对症治疗控制。没有患者因不良反应而停止阿帕替尼治疗,也没有患者死于药物相关原因。
图1低剂量阿帕替尼单药作为转移性结直肠癌患者三线治疗的抗肿瘤活性
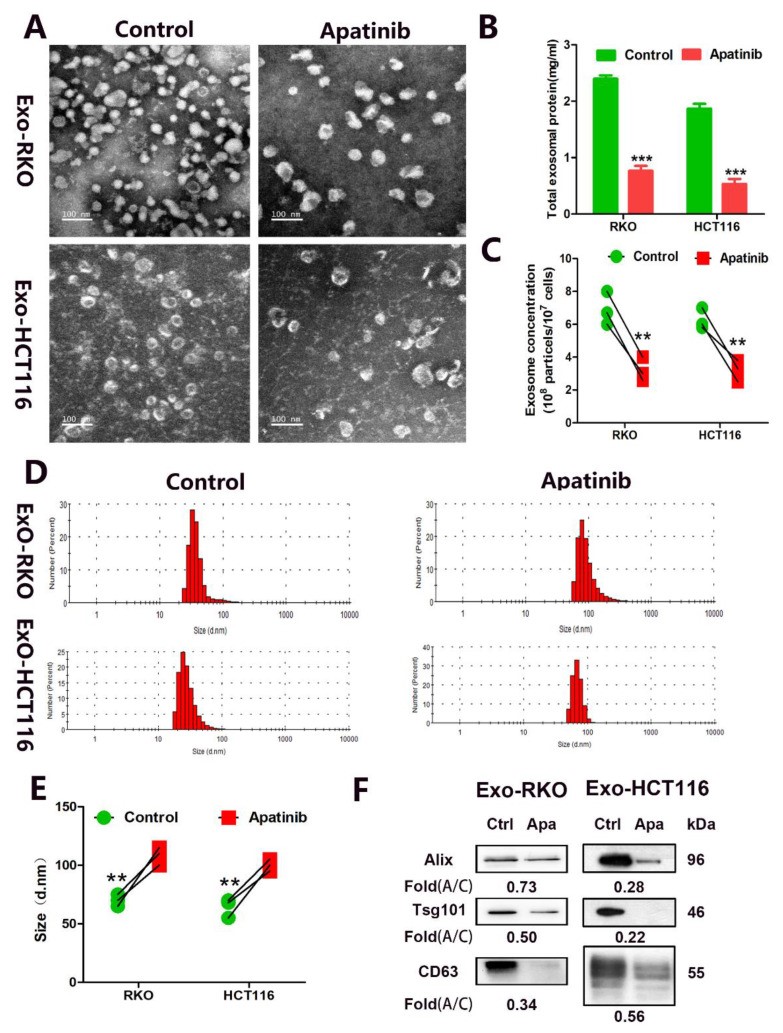
低剂量阿帕替尼在治疗结直肠癌方面的类似效果可能表明除了血管生成之外还涉及一些新的机制。因此,研究人员通过RNA-seq探索阿帕替尼在结肠癌中的新作用。分析结果表明,外泌体与阿帕替尼的抗CRC活性有关。研究人员从阿帕替尼处理的CRC细胞的上清液中分离出外泌体,进行体外分析。发现阿帕替尼能够减少CRC细胞外泌体的分泌,并且阿帕替尼处理的细胞可以分泌稍大的外泌体。
图2阿帕替尼在体外抑制 CRC 细胞中的外泌体分泌
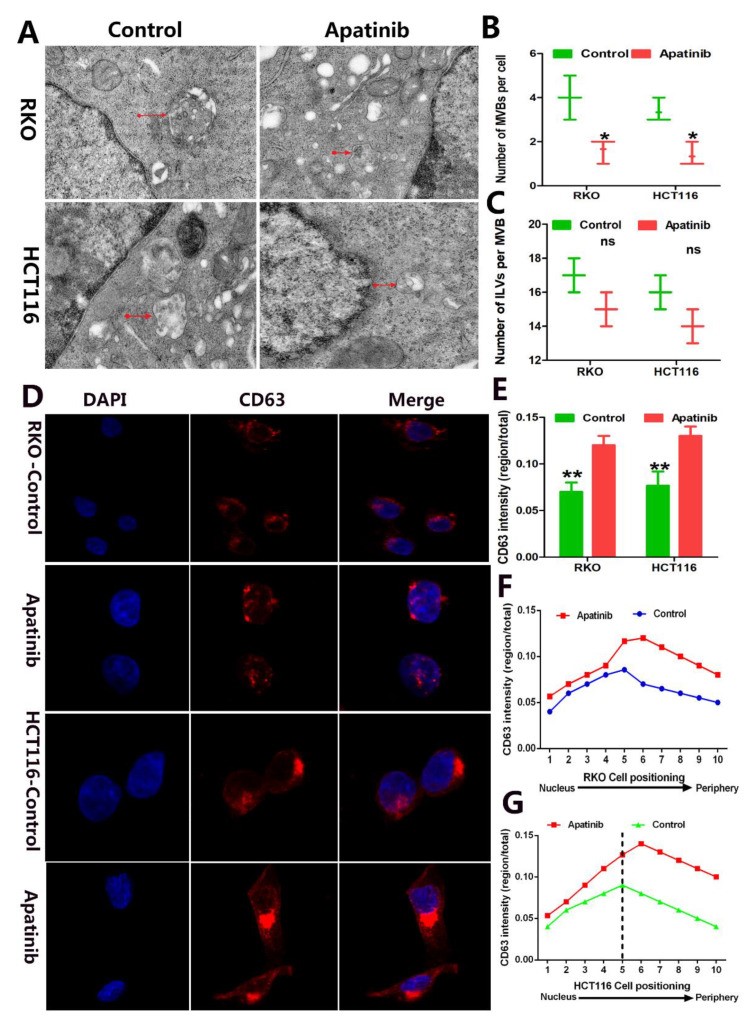
MVB含有腔内囊泡(ILV)。当中微静脉蛋白与质膜融合时,ILV被释放形成外泌体。为了研究阿帕替尼导致CRC细胞中外泌体分泌受损的分子机制,研究人员分析了阿帕替尼处理后CRC细胞中ILV和MVB的数量和形态。CD63是一种标记MVB腔内囊泡(ILV)的四次跨膜蛋白,在阿帕替尼治疗后增加。表明CRC细胞中的阿帕替尼治疗显着抑制了MVB的靶向转运。
图3阿帕替尼抑制 CRC 细胞中 MVB 向质膜的转运
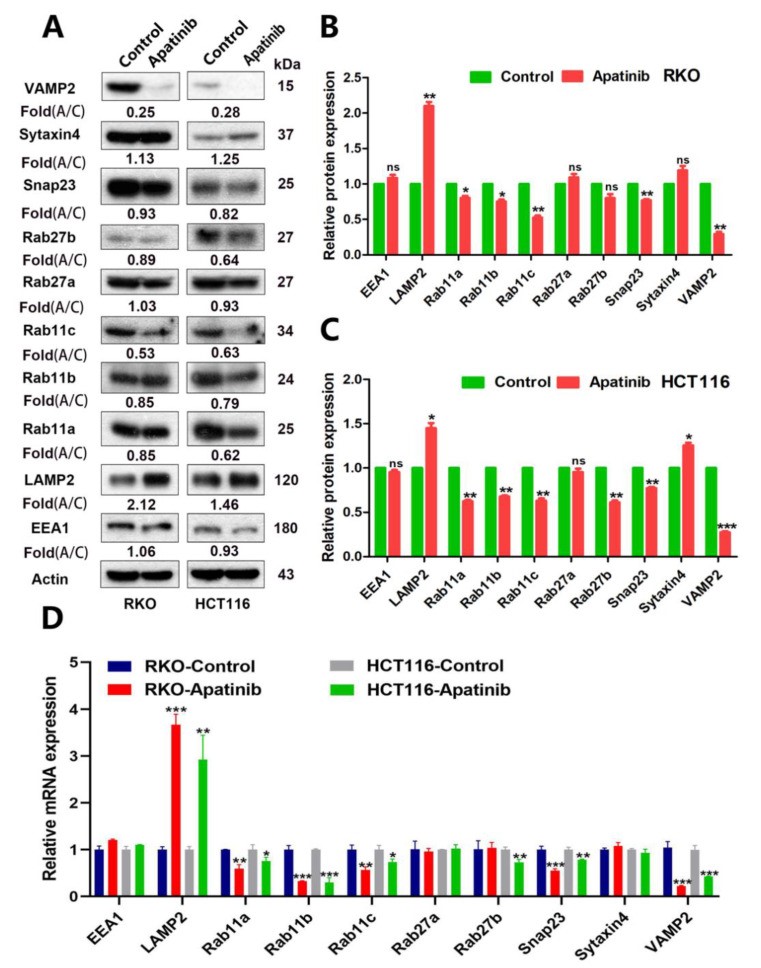
MVBs数量的增加可能是由于MVBs生物发生的大量增加或MVBs的运输和降解受到抑制。为了研究阿帕替尼如何调节MVB和外泌体释放的基本分子机制。研究人员分析了阿帕替尼处理后,CRC细胞中MVB生物发生相关蛋白,参与外泌体分泌的Rab GTP酶和参与外泌体质膜融合的SNARE复合物的变化。有趣的是,阿帕替尼调节了许多与 MVB 转运相关的蛋白质的表达,例如引起与 MVB 转运和膜融合密切相关的 Rab11s、VAMP2 和 Snap23 的下调,以及与 MVB 溶酶体降解相关的 LAMP2 的上调。总之,阿帕替尼抑制 MVB 转运并加速 MVB 降解,进而减少外泌体分泌。
图4阿帕替尼调节参与外泌体释放的相关分子的表达
综上所述,这项回顾性研究表明,低剂量阿帕替尼(250 mg,每日一次)单药治疗在晚期结直肠癌的三线治疗中有效,可显著改善患者的生活质量,并引起可耐受的不良反应。值得关注的是,该研究首次证实,阿帕替尼治疗通过调节MVB生物发生抑制外泌体的分泌。这种新颖的调节机制为阿帕替尼在CRC治疗中的抗肿瘤作用提供了新的视角。
参考文献:
Studies of the Efficacy of Low-Dose Apatinib Monotherapy as Third-Line Treatment in Patients with Metastatic Colorectal Cancer and Apatinib's Novel Anticancer Effect by Inhibiting Tumor-Derived Exosome Secretion,Cancers (Basel). 2022 May 19;14(10):2492. doi: 10.3390/cancers14102492.