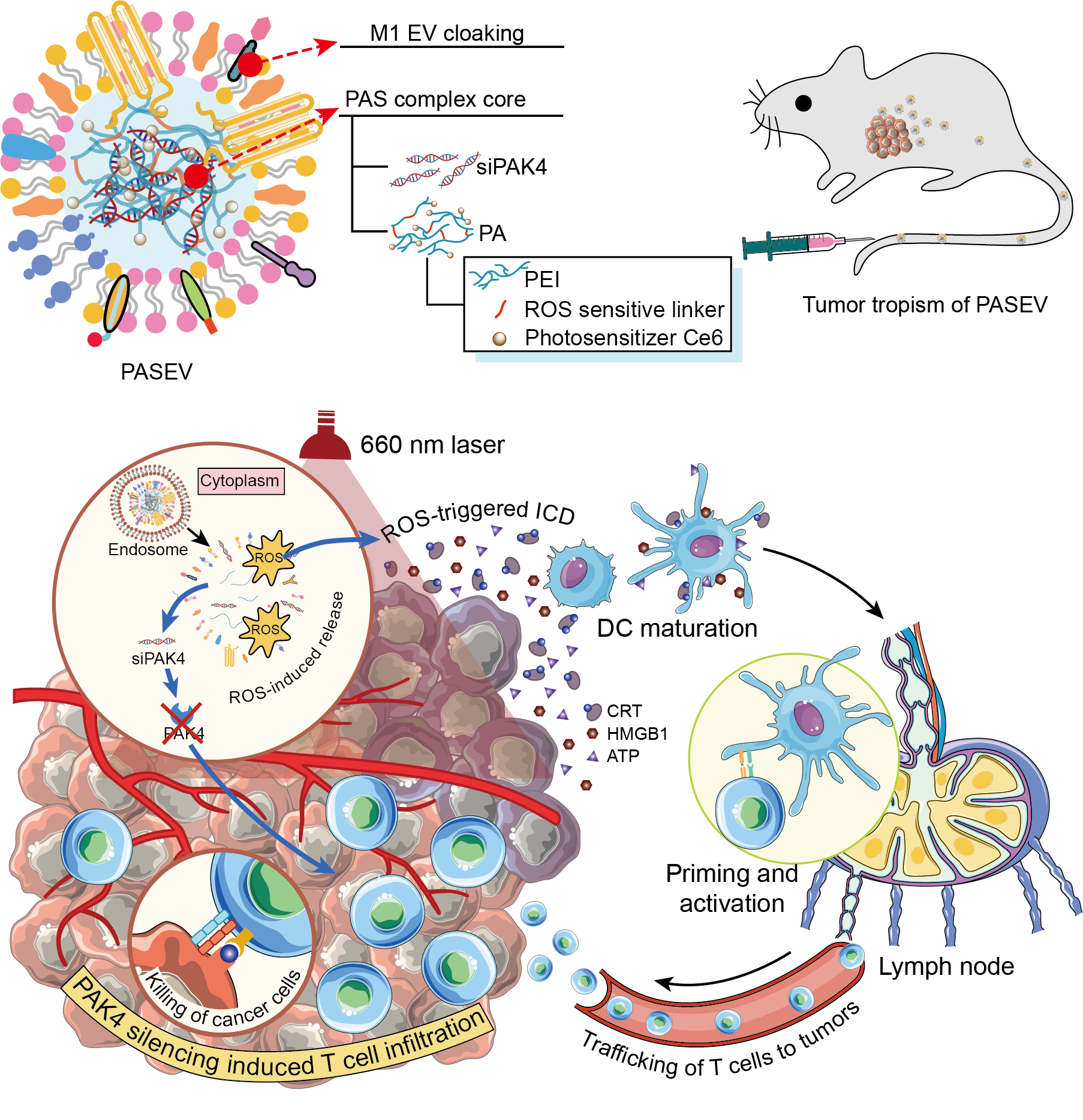
肿瘤免疫疗法极大地改变了当前肿瘤治疗的现状。然而,临床上患者对单一免疫疗法的总体响应率仅为10-30%。究其根源,除了肿瘤本身免疫原性弱外,肿瘤内部免疫细胞浸润不足也是免疫疗法响应率低的重要原因。胞外囊泡是新一代的药物递送载体,其具有良好的生物相容性、低免疫原性、良好的循环稳定性、膜渗透性、肿瘤趋向性等优势,近年来被广泛用于siRNA等核酸药物的递送。近日,国家纳米科学中心梁兴杰团队与北京理工大学黄渊余团队合作,在国际顶级期刊Advanced Materials发表题为“Photo-activatable Silencing Extracellular Vesicle (PASEV) Sensitizes Cancer Immunotherapy”的研究论文 (2022 Jul 6:e2204765),第一作者为陆梅博士、邢昊楠博士。
该研究设计了一种新型的光激活胞外囊泡(PASEV)用于增敏肿瘤免疫治疗。首先,设计了可特异沉默肿瘤阻止免疫细胞浸润、实现免疫逃逸的关键靶点PAK4表达的siRNA(siPAK4),并将其与光可激活、活性氧(ROS)敏感的聚乙烯亚胺(PEI)进行组装,形成纳米复合物。然后,用M1型巨噬细胞的胞外囊泡对纳米复合物核心进行伪装,赋予其良好的生物相容性、低免疫原性、良好的循环稳定性及肿瘤趋向性。研究结果表明,PASEV不仅可高效包载siPAK4,增强体内稳定性和肿瘤蓄积,响应光调控,促进siPAK4内涵体逃逸及胞内释放,有效沉默肿瘤“守卫兵”PAK4的表达,从而阻断WNT/β-catenin信号通路,促进免疫细胞深入肿瘤内部。而且该胞外囊泡可通过诱导肿瘤免疫原性细胞死亡(ICD)级联反应,增强肿瘤的免疫原性,促进树突状细胞成熟,激活肿瘤特异的杀伤性T细胞对肿瘤的攻击。
该研究在一个胞外囊泡体系中,将RNAi诱导的肿瘤免疫浸润与免疫原性光疗法结合起来,同时提高肿瘤组织中免疫细胞的数量和活性,为提高当前肿瘤免疫治疗应答率,实现免疫增敏开辟了一条新途径。参考文献:Photo-Activatable Silencing Extracellular Vesicle (PASEV) Sensitizes Cancer Immunotherapy, Adv Mater. 2022 Jul 6;e2204765. doi: 10.1002/adma.202204765.
外泌体资讯网 Adv Mater | 国家纳米科学中心梁兴杰团队与北京理工大学黄渊余团队发表研究性工作:光激活胞外囊泡用于增敏肿瘤免疫治疗