帕金森病的特征是错误折叠的α-突触核蛋白组成的神经元内包涵体逐渐出现,导致细胞毒性和神经死亡。最近的体外和体内研究表明,错误折叠的α-突触核蛋白可能以朊病毒样方式跨细胞传播,在健康神经元中诱导病理聚集,并通过细胞外囊泡的分泌进行传播。因此,来自帕金森病患者的脑裂解物和脑脊液的细胞外囊泡被证明可以导致健康细胞中的α-突触核蛋白聚集增加。有研究推断嗅球是帕金森病发病的主要传播部位之一,因此,近日发表在Brain杂志的一篇报道试图研究细胞外囊泡在α-突触核蛋白的传播和帕金森病通过嗅球进展中的作用。
帕金森病是一种常见于老年的神经退行性疾病。它的特点是运动和非运动缺陷以及从黑质致密部(SNpc)投射到纹状体的多巴胺能神经元进行性丧失。研究表明,多巴胺能神经元的退化主要是由路易体中神经组织表达的α-突触核蛋白的异常积累引发的,这是帕金森病的神经病理学标志。在正常情况下,α-突触核蛋白存在于胞质溶胶作为可溶性和天然未折叠的单体或处于多聚体膜结合状态。它的作用仍不清楚,但有研究推断它参与了与突触活动和囊泡运输相关的调节功能。在致病过程中,α-突触核蛋白错误折叠并形成有毒的寡聚中间体和不溶性蛋白原纤维。引起α-突触核蛋白聚集的因素仍然未知。然而,已经确定α-突触核蛋白可以以朊病毒样方式从一个细胞传递到另一个细胞,并在健康细胞中诱导致病构象。此外,注射预先形成的α-突触核蛋白原纤维足以引发不溶性聚集体,这些聚集体可以在小鼠模型的整个大脑中扩散。
根据Braak及其同事的“双重打击假说”,路易体病理学最初发生在嗅球或胃肠道,正如在死后人脑研究中观察到的那样,在帕金森病的早期(前驱)阶段,通常是局限于迷走神经的嗅球和背运动核。这与出现运动症状(如嗅觉功能障碍、快速眼动睡眠行为障碍和便秘)前几年在患者中观察到的缺陷一致。只是后来,在疾病进展过程中,在中脑中观察到路易体病理学,影响SNpc和其他区域。最近的研究集中在使用实验室制造的预制α-突触核蛋白原纤维从模拟嗅球或肠道到大脑的疾病进展,然而,这些原纤维不能准确地模拟疾病的病理生理学。
越来越多的证据表明,小细胞外囊泡(EV)在病理性α-突触核蛋白聚集中发挥着重要作用。EV通过内体膜向内内陷形成多泡体,与质膜融合或通过从质膜直接向外出芽而经历生物发生。它们从多种细胞中释放出来,包括神经元、小胶质细胞和星形胶质细胞,作为细胞间通讯的介质,据报道它们可以通过血脑屏障。EVs货物由核酸、蛋白质和脂质组成,可在与质膜融合后调节受体细胞中的蛋白质表达。研究表明,可在源自帕金森病患者体液(如CSF和血清)的EV中检测到α-突触核蛋白的可溶性和聚集变体。发现EV本身为α-突触核蛋白聚集的成核提供了催化环境,并且与游离α-突触核蛋白寡聚体相比,EV相关的α-突触核蛋白寡聚体被受体细胞更有效地吸收并且具有更高的毒性。当溶酶体和巨自噬机制受损时,EV转移增加。与细胞中的α-突触核蛋白降解有关的这些通路在帕金森病中发生了改变。
细胞层面的体外实验发现,来自帕金森病患者CSF的EV诱导α-突触核蛋白病理聚集。此外,使用源自帕金森病患者血清或路易体痴呆患者脑裂解物的EV对小鼠进行长时间的静脉内或纹状体内处理,会引起SNpc中的蛋白质聚集和运动缺陷。这些研究结果表明,EV可以作为一种机制,将α-突触核蛋白和其他病原体扩散到健康神经元,从而引发帕金森病的症状。该研究的目的是在小鼠模型中研究短期鼻内给药来自帕金森病患者的CSF衍生EVs的效果。试图首次验证这些EV诱导α-突触核蛋白聚集和帕金森病相关病理学的能力,包括鼻内给药的运动和非运动缺陷。
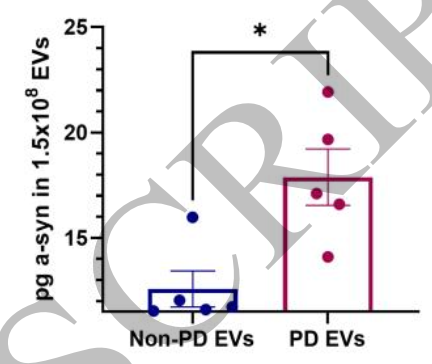
帕金森病患者来源的EVs中α-synuclein含量显著多于非突触核蛋白类神经退行性疾病患者的EVs
将来自诊断为帕金森病(实验组)或非突触核蛋白病神经退行性疾病(对照组)患者的脑脊液的细胞外囊泡经鼻内给予健康小鼠,每天一次,持续4天。三个月后,对小鼠进行运动和非运动测试。EVs处理8个月后,通过对与帕金森病病理学相关的中脑结构的组织化学分析阐明了功能障碍。
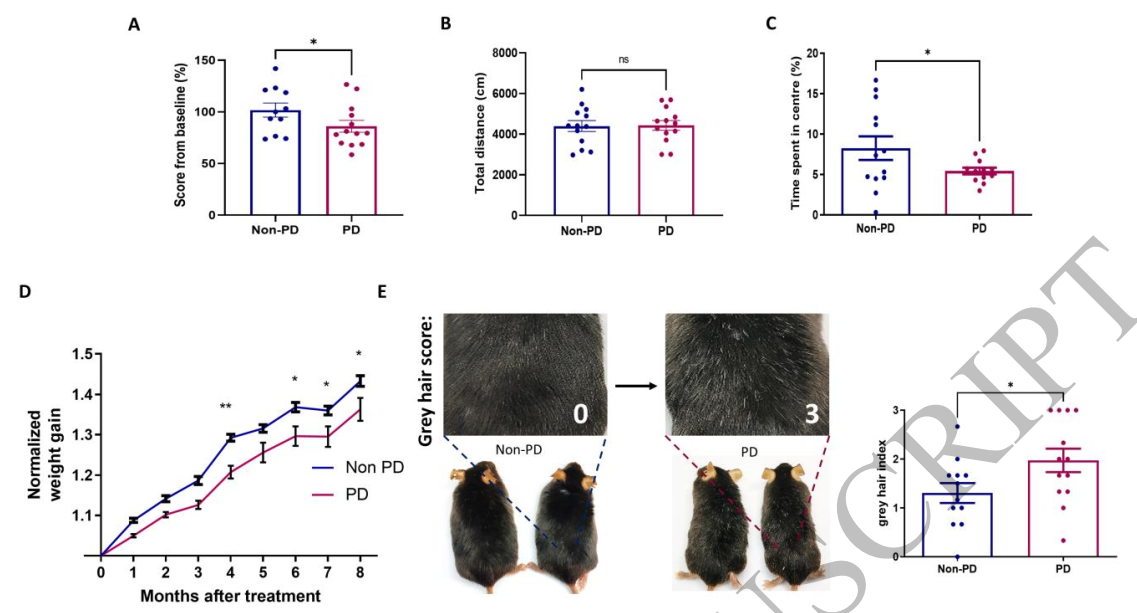
来自帕金森病患者的EV鼻内给药在健康小鼠中引发5种运动和非运动行为缺陷
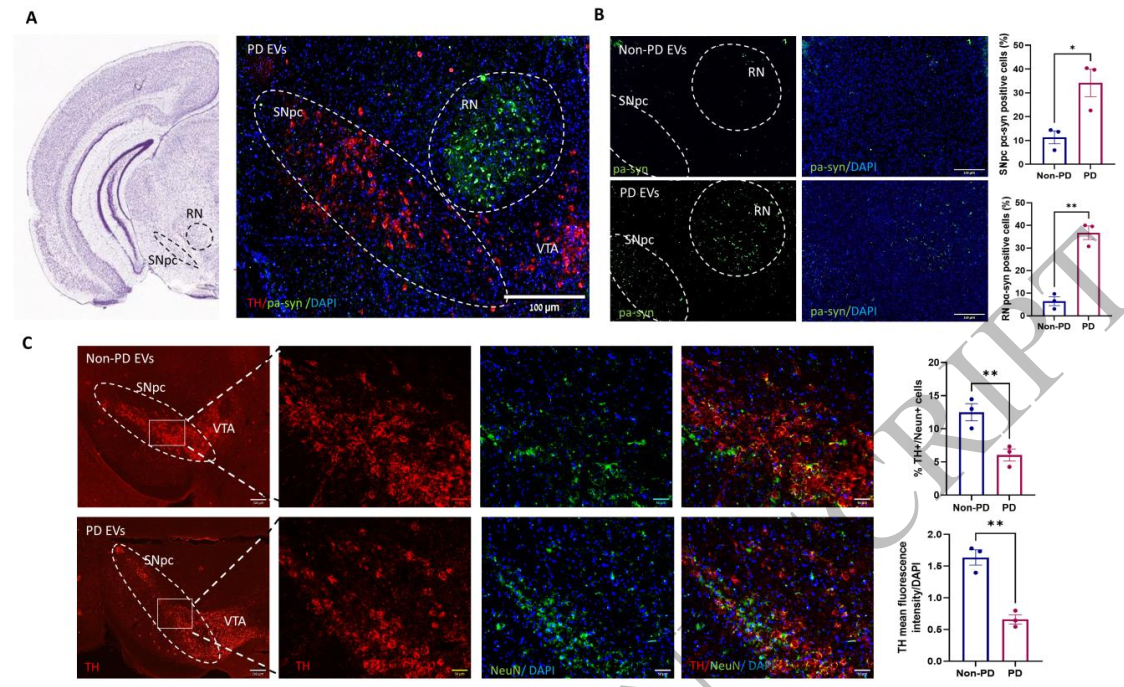
用来自帕金森病患者的细胞外囊泡处理的小鼠表现出与前驱期和临床期帕金森病一致的多种症状,例如嗅觉减退、运动行为障碍和高度焦虑。此外,它们的中脑表现出广泛的α-突触核蛋白聚集、多巴胺能神经变性、神经炎症和自噬活性改变。还观察到了几种非常规的病理情况,例如红核中的α-突触核蛋白聚集、过早白发的生长和星形胶质细胞增生。
来自帕金森病患者的EV鼻内给药在健康小鼠的中脑中诱导pα-突触核蛋白聚集和黑质神经变性
总的来说,这些数据表明,从帕金森病患者的脑脊液中提取的细胞外囊泡鼻内给药可以在体内传播α-突触核蛋白聚集,并在健康小鼠中引发帕金森病样症状和病理。
参考文献:
Herman S, Djaldetti R, Mollenhauer B, Offen D. CSF-derived extracellular vesicles from patients with Parkinson's disease induce symptoms and pathology. Brain. 2022 Jul 26:awac261. doi: 10.1093/brain/awac261. Epub ahead of print. PMID: 35881523.