骨髓间充质干细胞来源外泌体(exosomes derived from mesenchymal stem cells, MSC-Exo)已被证明在脊髓损伤(spinal cord injury, SCI)治疗中展现出巨大潜力。然而,传统的二维(two-dimensional, 2D)培养方式不可避免的导致MSC干性降低或丧失,在很大程度上限制了MSC-Exo的临床应用。MSC三维(three-dimensional, 3D)培养后分泌的外泌体(3D-Exo)则具有更高的神经修复效率,在SCI治疗中具有广阔的应用前景。传统的外泌体治疗依赖于在损伤部位反复注射给药,但可导致额外的二次损伤和药效低下的弊端。因此,迫切需要开发一种更可靠和更高效的外泌体递送方法。近日,来自山东第一医科大学第一附属医院辛涛教授团队与山东大学晶体材料国家重点实验室刘宏教授的研究人员在Nano Lett上发表了以“Three-Dimensional-Cultured MSC-Derived Exosome-Hydrogel Hybrid Microneedle Array Patch for Spinal Cord Repair”为题的研究论文(doi: 10.1021/acs.nanolett.2c02259),报道了一种自主设计的凝胶微针,可通过负载3D-Exo的阵列贴片来实现外泌体在SCI的原位修复。山东第一医科大学在站博士后韩敏与山东大学晶体所博士研究生杨鸿儒为论文的共同第一作者,山东第一医科大学第一附属医院辛涛教授与山东大学晶体材料国家重点实验室刘宏教授为论文的共同通讯作者。

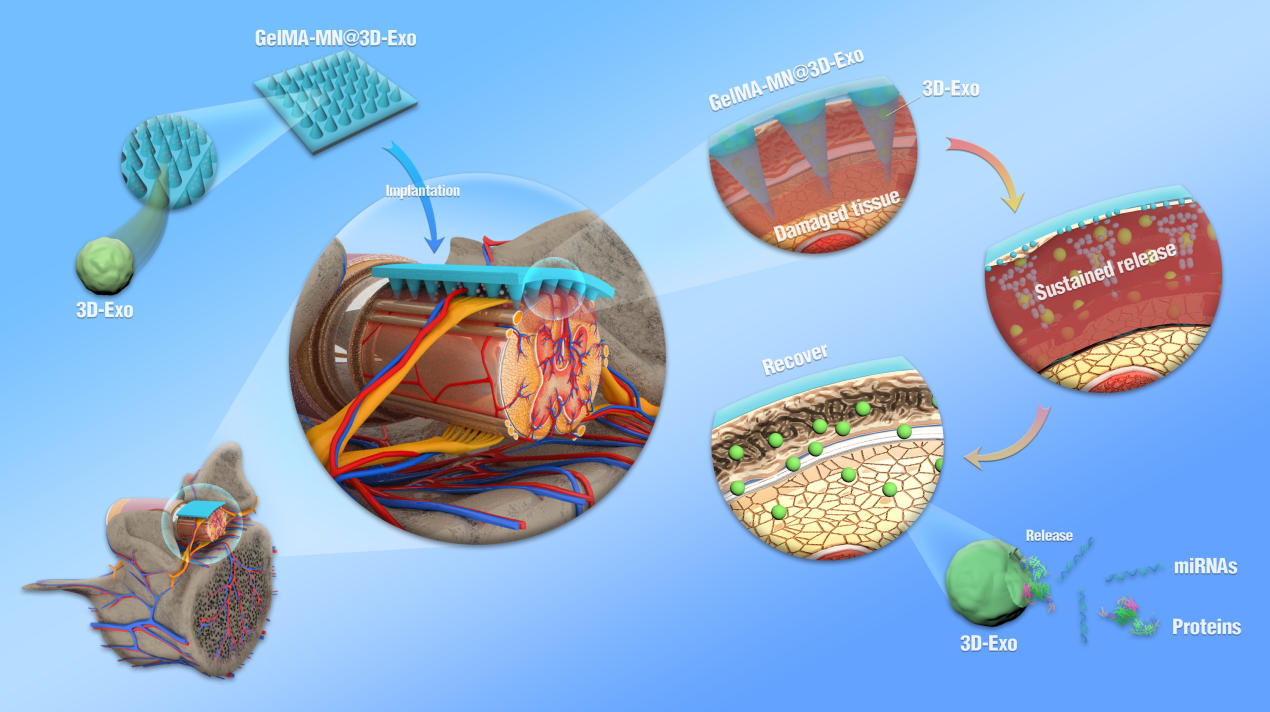
鉴于目前常规2D细胞培养导致干细胞干性不足、Exo产量低下的弊端,采用水凝胶3D培养MSC提高细胞干性及3D-Exo产量;针对Exo系统给药带来的靶向性不足及在损伤部位反复注射给药带来的额外损伤,该研究构建了GelMA-MN@Exo微针阵列贴片并用于SCI的原位治疗。与常规2D培养相比,GelMA水凝胶3D培养MSC可高效分泌具有更多神经保护相关内容物的Exo。在该研究中,研究者通过四维蛋白质谱分析和转录组测序寻找2D及3D-Exo内差异蛋白及miRNAs分子。蛋白测序结果表明,3D-Exo中上调的蛋白分子主要参与CNS的重塑;转录组测序筛选差异表达miRNAs并进行靶基因预测及功能富集分析,发现靶基因主要富集在细胞信号、细胞应激和免疫应答方面。KEGG富集分析发现,通路主要富集在神经系统能量代谢、神经修复及细胞信号转导。测序证实了2D和3D-Exo中蛋白质与miRNAs间的差异,这些差异分子在一定程度解释3D-Exo在SCI中发挥更强神经保护作用的原因。GelMA-MN@Exo系统的局部植入显著提高了Exo的递送效率并克服常规Exo系统给药靶向性不足的障碍。MSC-Exo可在SCI损伤区域缓慢释放Exo,减轻神经炎性反应、促进小胶质细胞向M2表型极化、减轻胶质瘢痕形成促进神经功能损伤的修复。

图1 GelMA-MN@3D-Exo对于脊髓损伤大鼠的修复效果该研究表明水凝胶3D培养的MSC可最大限度保持其细胞干性,3D-Exo可在损伤原位稳定释放并有效减少SCI诱导的神经炎症反应和胶质瘢痕产生,为SCI的修复及其他器官和组织的损伤等领域提供了一定的理论指导意义。
参考文献:Three-Dimensional-Cultured MSC-Derived Exosome-Hydrogel Hybrid Microneedle Array Patch for Spinal Cord Repair, Nano Lett. 2022, doi: 10.1021/acs.nanolett.2c02259
外泌体资讯网 Nano Lett | 山东第一医科大学一附院辛涛与山东大学刘宏:水凝胶微针负载3D培养MSC-Exo在脊髓损伤中的应用研究




