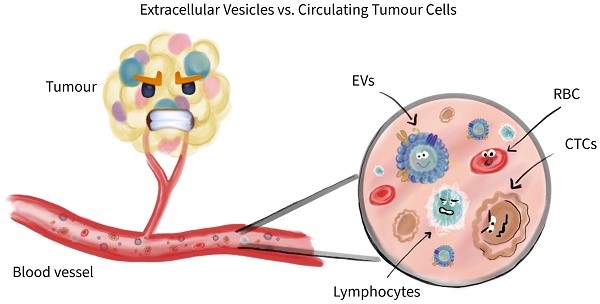
传统的癌症液体活检主要以一些公认的标志物检测为主,但在临床使用期间,很多标志物在统计学意义和其稳健性上存在局限性,越来越多的液体活检标志物在癌症诊断或其他相关临床指南中被删除。来自波兰托伦哥白尼大学的研究人员发表文章认为,细胞外囊泡 (EV) 与循环肿瘤细胞 (CTC) 才能称得上是真正意义上的液体活检,并对二者表征、量化、抗原信息、下游应用等方面进行比较,认为二者在癌症诊断中具有互补价值。这项以“Extracellular Vesicles and Circulating Tumour Cells - complementary liquid biopsies or standalone concepts?”为题的综述性论文于8月1日在Theranostics期刊上发表。
早在1966年,Wichelhausen等人发表了最早的关于液体活检的报告,该报告通过获取了患者的细胞组织,然后进一步培养并进行相应的分析。1990年,另一项重要研究显示,血清样本中前列腺特异性抗原 (PSA) 与前列腺癌肿瘤体积和分化以及良性前列腺增生体积相关。1991年《新英格兰医学杂志》上一份备受推崇且极具影响力的研究确立了通过PSA液体筛查前列腺癌的黄金标准。1994年,美国食品和药物管理局 (FDA) 批准PSA与直肠指检(DRE) 相结合检测前列腺癌。另一种液体活检癌症生物标志物曾被认为可能将肝细胞癌 (HCC) 的筛查和诊断提升到另一个水平,即甲胎蛋白 (AFP)。该生物标志物甚至曾被推荐纳入多个国际和国家指南。非常不幸的是,AFP 已被证明不敏感,因为它仅在40-60%的HCC 病例中升高,特别是在疾病早期。
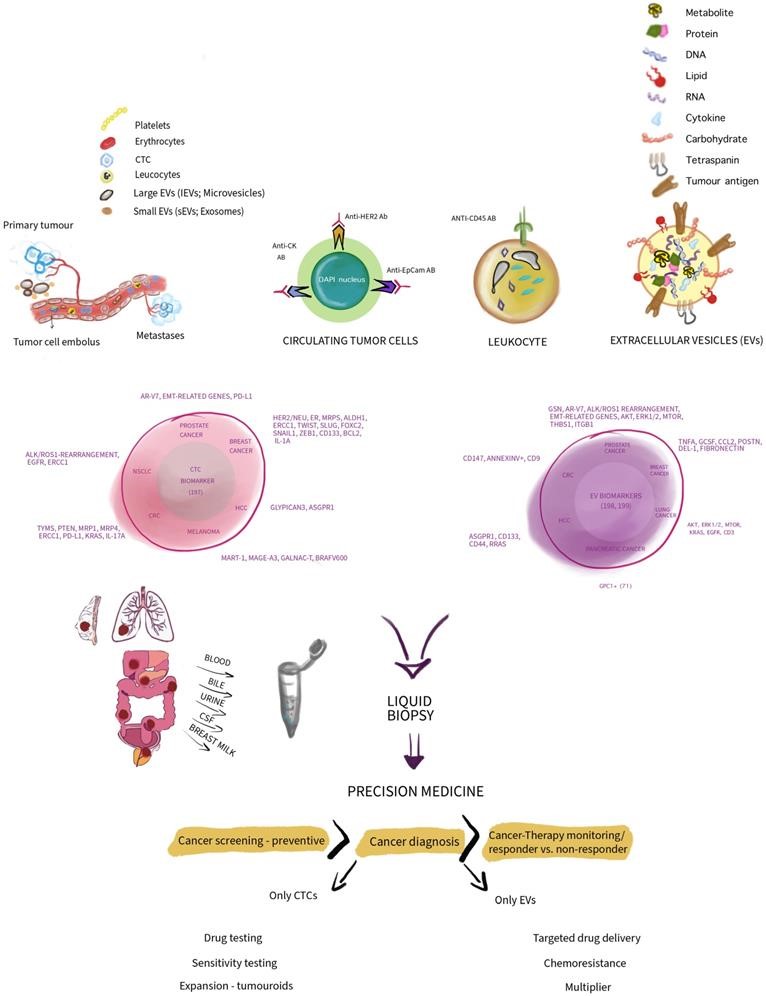
除了这两种基于蛋白质的液体活检癌症生物标志物外,随后更多的癌症液体活检生物标志物备开发。特别是在过去的15年,“肿瘤循环物”,包括循环肿瘤细胞 (CTC)、细胞外囊泡 (EV)、游离肿瘤DNA (ctDNA)、游离DNA (cfDNA)、循环肿瘤RNA (ctRNA) 和肿瘤诱导血小板 (TEP) 进入了人们的视线。所有这些生物标志物都属于液体活检的范畴,或者被认为叫做精准医学。在这篇综述里,研究人员特别讨论了EV和 CTC之间用作液体活检的差异和相似之处,全面指出了他们在癌症筛查和诊断中的局限性和优势。
研究人员认为,在癌症液体活检的情况下,想要实现强大的高灵敏度和特异性的应用,可能未来最具前景的是CTC和EV。CTC已经被FDA批准用于某些类型的实体癌症的诊断,因为CTC主要来自具有转移性的上皮实体肿瘤,而EV是高度实验性的标志物,没有被完全开发,因此具有很大的前景。
研究人员对CTC和EV进行了深入讨论和比较。有趣的是,CTC和EV都可以被视为肿瘤细胞对抗我们身体正常组织的工具,但同时也是癌症筛查、诊断、治疗监测的示踪剂。如下图所示,图中给出了CTC和EV的单独能力,两者之间不共享。CTC可能以各种方式用作类肿瘤成分,用于测试药物敏感性。EV可能被用作癌症治疗的载体,这可能是一个有希望的愿景,需要进行大量研究,EV也会用作癌症筛查。由于癌症进化中,癌细胞使用EV和CTC来促进癌症的生存和获得优势,我们也应该利用CTC和EV,不应仅仅将EV 和CTC 视为简单的生物标志物。EVs和CTCs 都协调了重要的致癌过程,但似乎EV在与致癌作用有关的启动过程中更为深远,而CTC则在后来产生的。但是,两者都有相同的目标:癌症进化。因此,二者在液体活检中谁更好?EV还是 CTC?这个问题并不重要。对于高度个性化药物,或者作为早期第一步癌症筛查,如能帮助每位癌症患者消除肿瘤、无继发性才能是真正赢家。
这篇综述主要以艺术化比较的方式描述CTC和EV的概念,突出并总结了它们在组成上的差异,提出了一些用于将CTC和EV与各种癌症相关联的标志物,展示了他们作为生物标志物如何在癌症精准医学和相关下游应用中得到应用。更多细节内容大家可以检索论文原文进行阅读。
参考文献:Extracellular Vesicles and Circulating Tumour Cells - complementary liquid biopsies or standalone concepts? Theranostics. 2022 Aug 1;12(13):5836-5855.