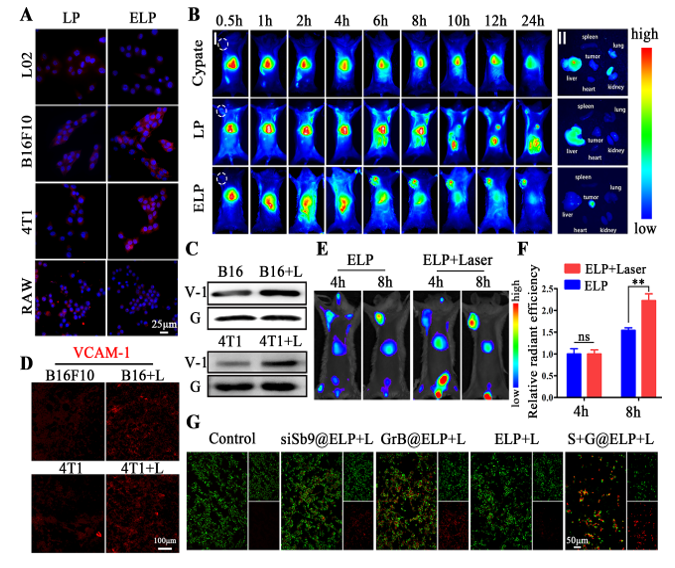
长久以来科研工作者一直致力于寻找高效的肿瘤治疗方法。颗粒酶 B (Granzyme B, GrB) 诱导的细胞凋亡一直被认为是细胞毒性 T 淋巴细胞 (Cytotoxic T-lymphocytes, CTL) 及自然杀伤细胞(Natural killer cells, NK) 用来清除有害靶细胞(包括病毒感染细胞和肿瘤细胞等)的主要机制,拥有比一般的效应分子更强大的疗效,因此具有广泛的应用前景。然而,有两个问题阻碍了它的进一步应用。一个是丝氨酸蛋白酶抑制剂SerpinB9 (Sb9)的存在,使肿瘤细胞对 GrB 的杀伤敏感度降低。另一个是单独的GrB进入靶细胞的效率不高。以细胞外泌体为材料来源构建的仿生药物递送载体因具有主动靶向性,内源性“货物”具有治疗功能、可免疫逃逸等特性为药物靶向递送入胞提供了新的可能。M1型巨噬细胞外泌体 (M1 Exosomes) 可凭借其上表达的α4整合素和肿瘤细胞上表达的血管细胞黏附分子 (Vascular cell adhesion molecule-1, VCAM-1) 结合而实现主动靶向,同时M1 Exo中含有极化促肿瘤的M2型巨噬细胞为M1型的细胞因子 (TNF-α, IFN-γ),因此具有强大的应用潜力,但其载药量差、内容物复杂等缺点限制了其进一步应用。2022年8月6日,中国药科大学顾月清教授、李斯文副教授团队在国际权威杂志Biomaterials上发表题为“Inhibition of SerpinB9 to Enhance Granzyme B-Based Tumor Therapy by Using a Modified Biomimetic Nanoplatform with a Cascade Strategy”的研究论文(2022, 6:121723),将M1 Exo与光热敏感脂质体 (LP) 膜融合,构建了改良的仿生纳米载体 (ELP) 来共递送GrB和Sb9的小干扰RNA (siSb9)。ELP不仅保留了M1 Exo的优势(肿瘤主动靶向、巨噬细胞极化、免疫逃逸等),还提高了载药能力,可将更多GrB递送入靶细胞。同时,联合光热治疗 (PTT),通过刺激肿瘤组织VCAM-1的表达,实现了递药系统对肿瘤的级联靶向,发挥免疫,基因和光热联合治疗效果。
一方面,仿生纳米载体注入体内后首先通过α4整合素与VCAM-1的结合实现肿瘤组织的主动靶向。联合PTT后产生的热效应引起肿瘤组织的VCAM-1表达水平上升,可募集更多仿生纳米载体靶向肿瘤组织,从而实现级联靶向效应。
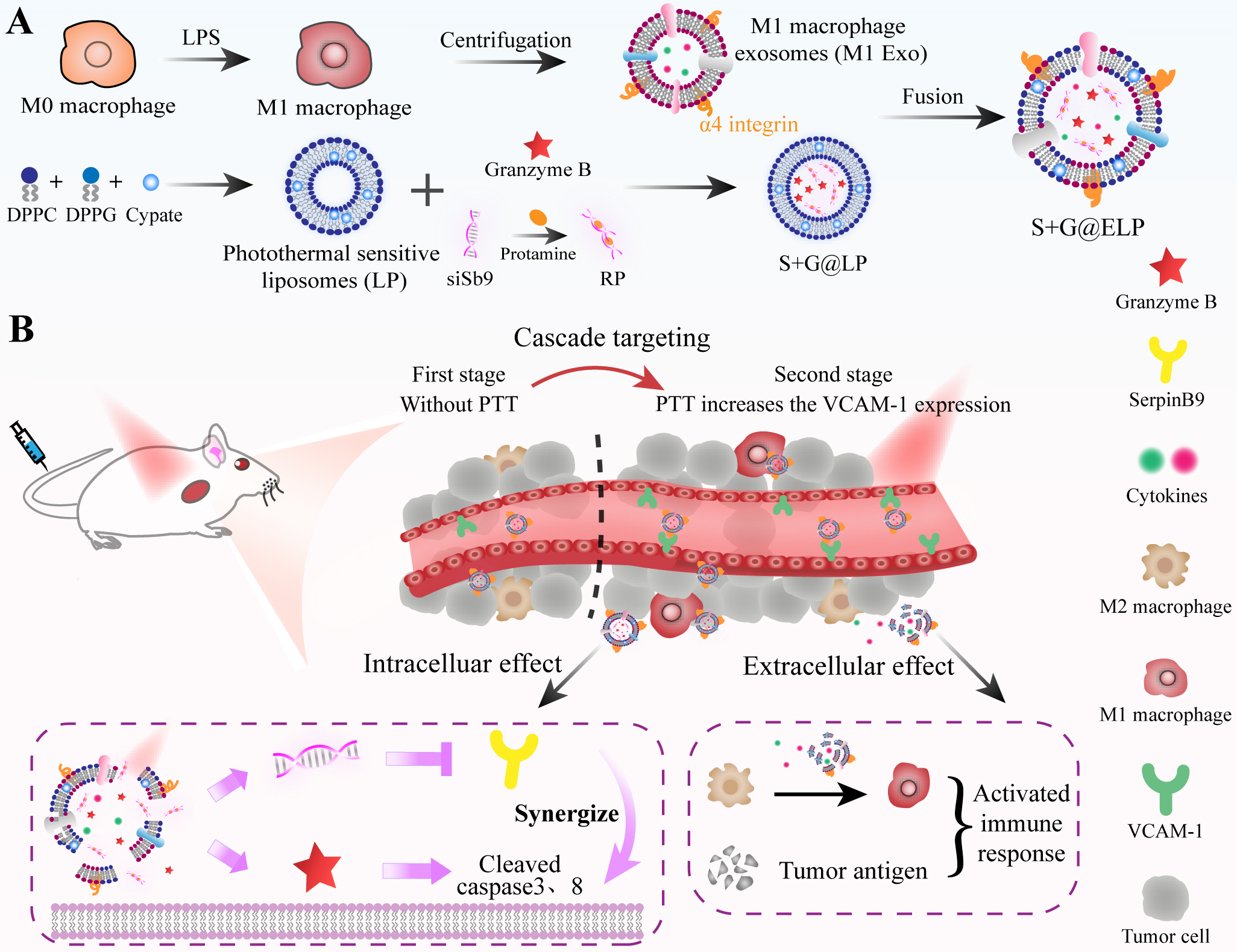
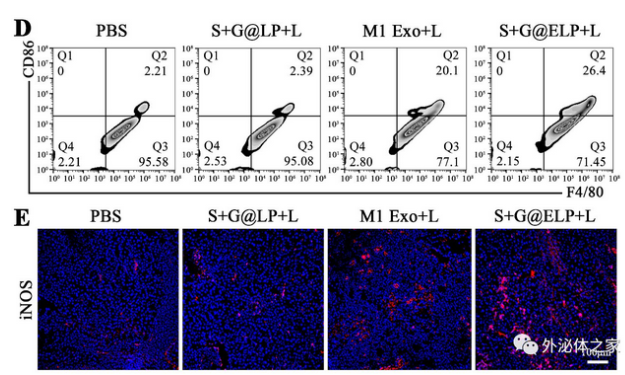
仿生纳米载体的主动靶向及光热效应引起的肿瘤级联靶向另一方面,通过不同的药物分组,体内外实验均表明单纯的GrB递送抑制肿瘤细胞生长的效果有限,而联合siSb9疗法后,肿瘤生长被显著地遏制,具有1+1>2的效应。加之,巨噬细胞的极化与PTT引起的细胞凋亡,共同激活了肿瘤微环境中的免疫反应,实现免疫,基因和光热三种疗法的协同治疗。
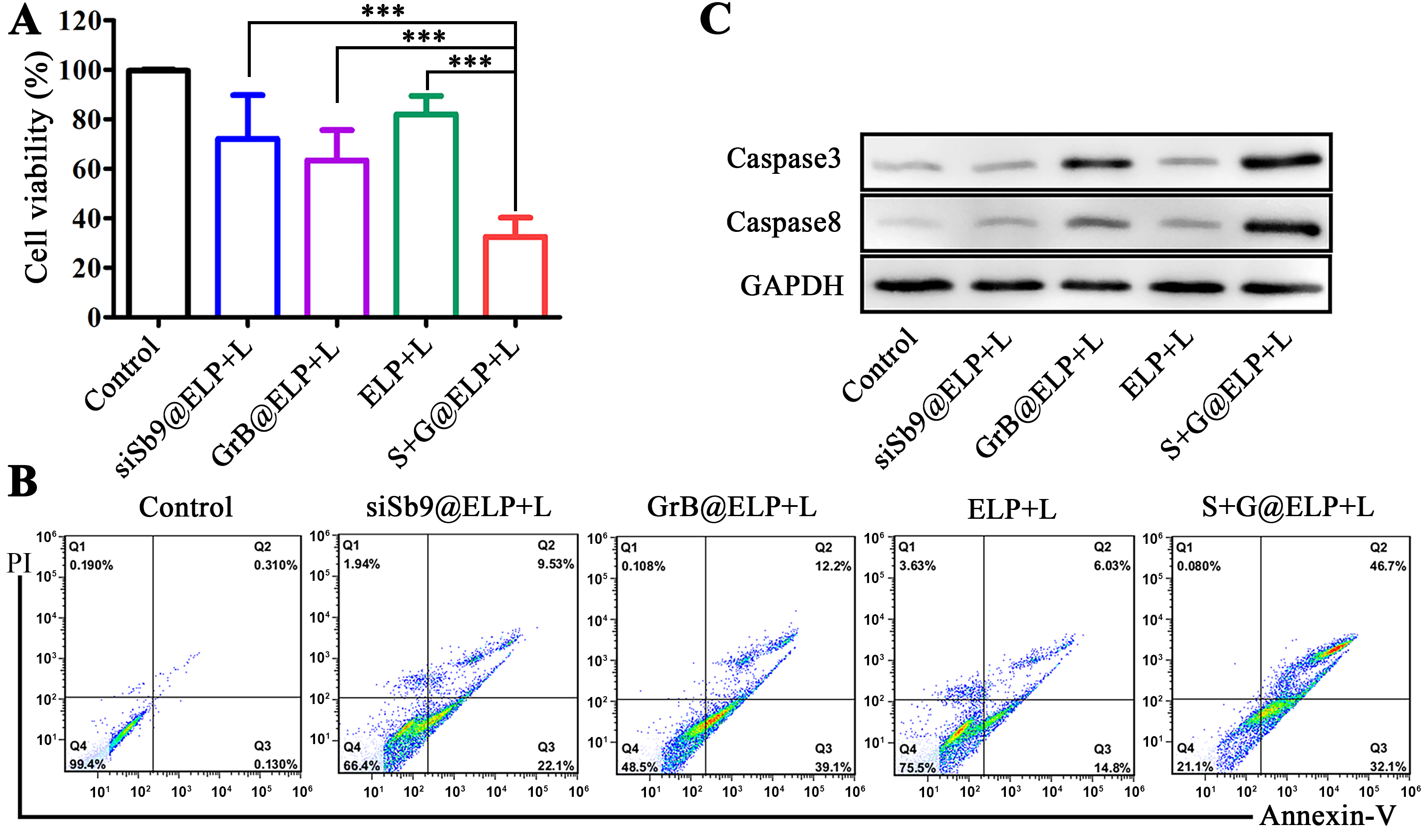
S+G@ELP联合热疗的体外协同杀伤效果
S+G@ELP联合热疗的体内极化效果研究人员在多种肿瘤模型中验证了该仿生纳米递药系统 (S+G@ELP)具有良好的治疗疗效,并对此改良的递药系统所引起的机体免疫效应进行了较深入的研究。综上所述,这种基于GrB的联合疗法在癌症治疗中具有广阔的应用前景。参考文献:Inhibition of SerpinB9 to enhance granzyme B-based tumor therapy by using a modified biomimetic nanoplatform with a cascade strategy.Biomaterials. 2022 Aug 6:121723. Epub ahead of print. doi:10.1016/j.biomaterials.2022.121723.
外泌体资讯网 Biomaterials | 中国药科大学顾月清、李斯文团队:改良仿生纳米平台用于增强基于颗粒酶B递送的肿瘤疗法