细胞外囊泡(EV)表面电晕正在成为EV功能的关键介质。近日,Nature Cell Biology杂志发表评论,讨论了EV电晕的作用和生物发生,以及确定生物效应是归因于内部EV货物还是与EV外表面相关的电晕的重要性。
细胞外囊泡(EV)由所有细胞释放,并在稳态过程和细胞间通讯中发挥关键作用。EV的一个关键特征是磷脂双层。EVs的脂质成分在不同类型的释放囊泡之间存在差异,它们的脂质壳包含脂筏和跨膜蛋白,例如四跨膜蛋白。几十年来,EV领域的研究人员投入了大量精力,将EV与污染的共分离蛋白质和脂蛋白区分开来。然而,这些努力或分离平台都没有促成纯EV的制备:纯化EV已被证明极具挑战性,而且只是部分成功——特别是在将EV从富含蛋白质的基质(如血浆)中分离时。
电晕形成的生物学意义
人们越来越认识到,与各种纳米颗粒表面相互作用的蛋白质要么促进纳米颗粒的细胞摄取,充当调理素(例如,LDL、IgG和C3b),要么通过充当抗调理素(例如,白蛋白、ApoA4,ApoC3和clusterin)来减少摄取。EV相关冠状蛋白的功能意义的重要证据来自一项研究,该研究将来自幼稚小鼠的血浆EV转移到患有活动性实验性过敏性脑脊髓炎(EAE)的小鼠体内。仅当纤维蛋白原与EVs相关时,这些EVs才会诱导自发的复发缓解CD8+-T细胞介导的EAE。另一项研究发现,通过尺寸排阻色谱法或EV超速离心去除EV电晕会消除其在血管生成、皮肤再生和免疫调节中的功能作用;用混合生长因子产生新的电晕恢复了EVs的功能效应。另一项有趣的研究报告说,脑转移瘤细胞(但不是原发性肿瘤细胞)释放的EV与LDL结合并诱导EV-LDL聚集;然后,EV-LDL聚集促进了单核细胞对EV的吸收,单核细胞在脑转移生态位中起关键作用。
细胞内获得性电晕的生物学意义的一个重要例子涉及成纤维细胞衍生的外泌体。一旦这些EV被乳腺癌细胞内化,它们就会获得表面相关的WNT11并在细胞中诱导自分泌Wnt-平面细胞极性信号,从而促进它们的侵袭行为。
最后,α-突触核蛋白与细胞内和细胞外的囊泡以及分泌的EV相关。α-突触核蛋白-EV相互作用促进α-突触核蛋白错误折叠并导致大原纤维的形成,这表明这种EV表面相互作用可能在突触核蛋白病中起关键作用。这些最近的研究有力地表明,EV的外表面可能发挥重要的细胞生物学作用,需要进一步解析,并且可能与我们对EV在疾病和治疗中作用的理解有关。
展望
关于EV潜在可交换电晕涂层的信息能否用于治疗应用?用蛋白质“外套”装饰新生的EVs或剥离的EVs是可行的。在最近的一项研究中,发现用angiopep-2肽修饰的合成EV模拟物与脂蛋白受体相关蛋白1(LRP1)受体结合并提高血脑屏障穿透能力。在EV模拟纳米颗粒表面存在angiopep-2导致血清蛋白电晕形成减少。有目的地用生长因子、细胞因子或酶装饰EV,或对它们进行工程改造并装载各种药物,可能会赋予EV独特的治疗潜力。
最后,积累的数据表明在EV周围形成了复杂而动态的生物电晕。尽管这种电晕的存在为EV结构增加了一层复杂性,但它也为EV定制和定位提供了机会。
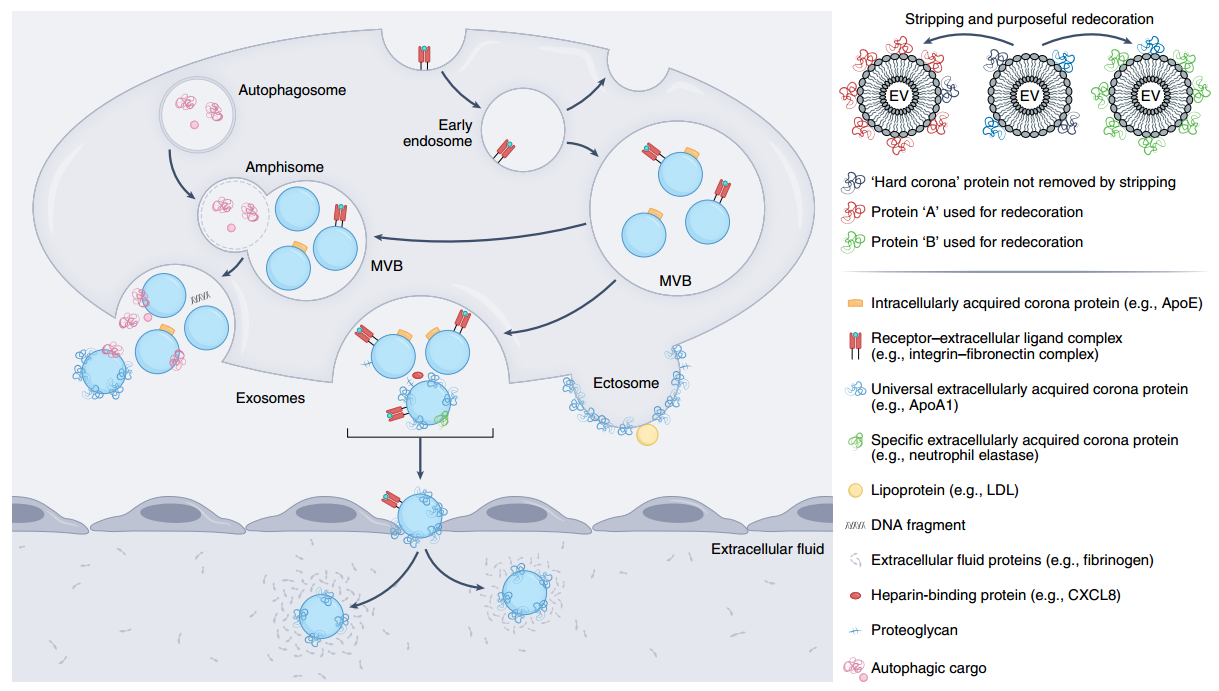
在EV周围形成生物分子电晕。蛋白质、蛋白质复合物、核酸和脂蛋白与EV的表面结合。电晕分子可以在细胞内、多泡体(MVB)或amphisomes或细胞外液(如血液)中与EV表面结合。通过从质膜出芽而从细胞中释放出来的EV,称为ectosomes,立即暴露于细胞外环境,因此总是与电晕蛋白相关联。内体衍生的EV,称为外泌体,一旦被细胞释放,或在EV生物发生和分泌过程中在细胞内释放,就会获得一个电晕。一些冠成分(“通用”成分)无处不在,存在于所有蛋白质冠中,而另一些则特定于释放细胞。新生EV(即在无血清条件下由细胞释放)或通过超速离心或尺寸排阻色谱法部分剥离的EV的生物分子电晕可以有目的地用其他功能性电晕涂层进行装饰。参考文献:Buzas EI. Opportunities and challenges in studying the extracellular vesicle corona. Nat Cell Biol. 2022 Aug 30. doi: 10.1038/s41556-022-00983-z. Epub ahead of print. PMID: 36042293.