细胞外囊泡(extracellular vesicles, EVs)是由细胞分泌的具有脂质双分子层结构的囊泡,携带DNA、RNA、蛋白质和脂质等生物活性分子,是细胞间通讯的重要载体,能够将其内的各种活性生物分子从EVs母细胞转运到相关受体细胞。这种能力使得EVs可作为新型的药物运载工具,克服其他药物递送系统存在的问题。近年来,多项研究证实RNA是EVs参与调控多种生理和病理过程的关键功能分子,在作为生物标志物方面也有着巨大的临床应用潜力。已有的EVs相关RNA研究,均是将大量EVs作为一个整体进行分析。目前缺乏在单EV水平分析单个EV所携带RNA的高通量分析方法,同时对单个EV中RNA的种类、数量和异质性等尚不清楚。
2022年9月6日,Small Methods杂志在线发表了华中科技大学郭安源教授团队题为Transcriptomic Features in a Single Extracellular Vesicle via Single-Cell RNA Sequencing的研究成果(2022 Sep 6:e2200881)。该研究首次通过改进的实验和分析方法,基于10x Genomics平台在单EV水平研究EVs的转录组特征。华中科技大学生命科学与技术学院郭安源教授和武汉大学中南医院的助理研究员雷倩为共同通讯作者,罗涛博士为该文章的第一作者。
该研究提出一种基于10x Genomics 平台的针对EV的高通量测序方法,在单EV水平对EVs转录组特征进行探究。作者使用Calcein-AM染料标记K562细胞和间充质干细胞来源的完整EVs,并通过流式细胞术检测EVs样本的浓度。分离的EVs使用10x Genomics 平台进行单EVs测序。在数据分析部分,作者经过多种尝试和改进,发现使用自适应阈值的CB2算法能有效地从背景中区分出真实的EVs。使用可靠的质控参数去除低质量数据,并使用DoubletFinder软件去除潜在的doublets。最终,在三个不同的EV样本分别获得了2088, 3935和1603个EV的转录组数据。
对EV转录组分析发现,单个EV中平均含有的mRNA基因数为52,不同EV从6到148个不等。较高比例的EVs中含有核糖体基因、线粒体基因和EEF1A1基因。K562细胞来源的EVs中含有很高的血红蛋白基因而间充质干细胞来源的EVs富有细胞骨架相关基因。此外,通过数据降维和聚类分析,作者证实了即使同种细胞来源的EVs仍具有高度的异质性,可划分为多个具有特异基因的不同的EVs亚群。
这项研究首次通过高通量的方法在单EV水平揭示EVs的转录组特征和异质性,刷新了人们对单个EV中RNA内容物的认识,为EV的功能研究和改造应用提供重要基础。
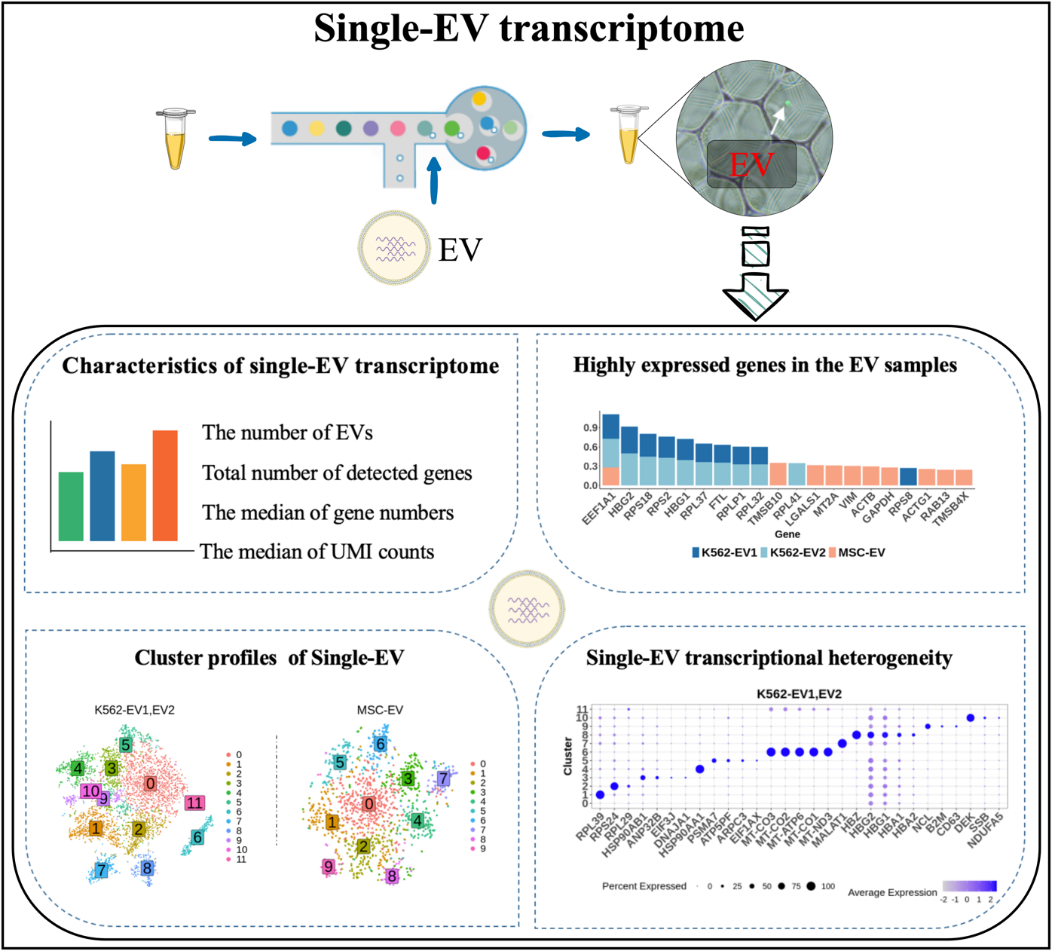
图一 基于单细胞测序技术的单EV转录组分析流程
该研究得到了国家重点研发计划,国家自然科学基金,湖北省自然科学基金和中南医院优秀博士计划等项目的资助,同时得到了武汉生物样本库有限公司的大力支持。
郭安源教授团队长期专注于肿瘤微环境中肿瘤细胞、免疫细胞和细胞外囊泡的研究,特别是针对细胞外囊泡,发展了一系列方法(EVAtool,Briefingsin Bioinformatics 2022,Bioinformatics 2020)和数据库(EVmiRNA和EVAtlas,Nucleic Acids Research 2019, 2022),分析发现并验证了细胞外囊泡的重要功能及其关键分子(Science Translational Medicine 2021, Cancer Letter 2022, Theranostics 2019, 2017, OncoImmunology 2018, Cancer Research 2016等)。
参考文献:Transcriptomic Features in a Single Extracellular Vesicle via Single-Cell RNA Sequencing. Small Methods. 2022 Sep 6:e2200881.





