小细胞外囊泡 (sEV) 为癌症诊断、预后和治疗方面提供了重大希望。然而,从含血清培养基中生长的细胞中分离sEV的方法缺乏标准化,比如,大多数研究人员使用含血清培养基进行sEV收获,并采用超速离心作为主要分离方法。但是,超速离心法效率低下,无法在不污染或不破坏sEV完整性的情况下得到sEV的高产量。来自澳大利亚QIMR Berghofer研究所的研究人员对切向流过滤法和超速离心法进行了比较,认为切向流过滤结合尺寸排阻色谱是最佳的分离方案,可用于更广泛的实验室环境,用于从含血清培养物中分离sEV。相关研究以“Comparative analysis of tangential flow filtration and ultracentrifugation, both combined with subsequent size exclusion chromatography, for the isolation of small extracellular vesicles”为题于9月20日在J Extracell Vesicles杂志上发表。
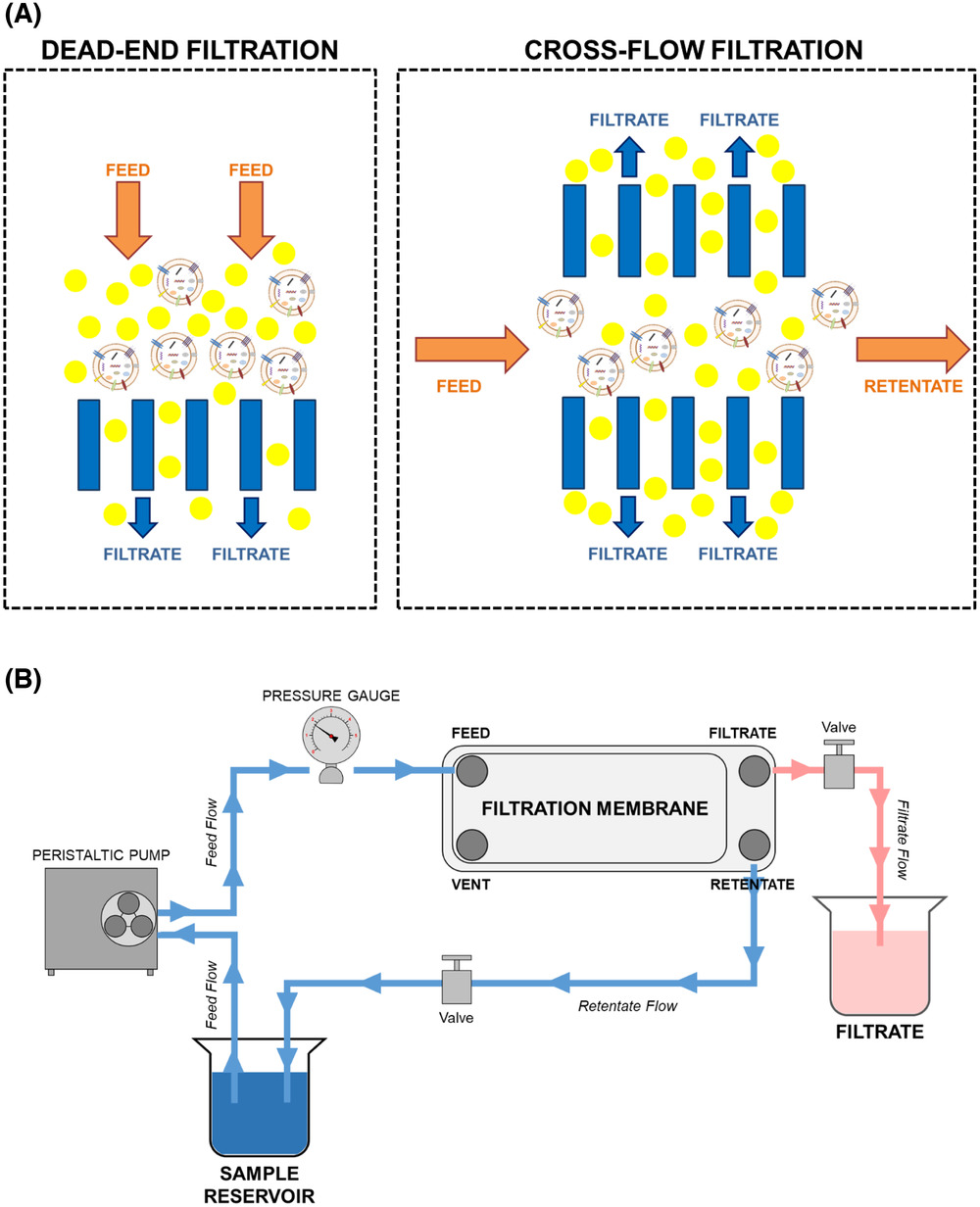
细胞外囊泡 (EV) 由于其自分泌和旁分泌信号传导,在癌症进展中发挥着至关重要的作用。近年来30到200 nm的小型EV (sEV) 的研究激增。这些细胞衍生的双脂膜颗粒含有复杂的货物,高度稳定并存在于所有体液中,是检测癌症生物标志物的绝佳候选者。此外,sEVs 在细胞间通讯中有效发挥作用,有助于了解癌症发病机制和癌症微环境过程,并为临床转化提供了巨大的希望。然而,由于基于sEV 的研究缺乏普遍共识,主要问题是缺乏最适当的分离纯化方法。基于离心的超滤技术结合尺寸排阻色谱是一种高效的sEV分离方法。然而,这种方法依赖于在无血清培养基中生长的细胞。大多数细胞类型需要胎牛血清 (FBS) 来补充营养并在其培养基中实现最佳生长,由于无血清是一种潜在的压力诱导因素,在无FBS 培养基中生长的细胞可能会改变其sEV含量和功能。大多数研究人员使用含血清培养基培养细胞以分离 sEV。因此,强烈需要开发一种能够从含血清培养基中生长的细胞中分离sEV的方案。大多数研究人员使用基于超速离心的方法从细胞培养条件培养基中分离 sEV。虽然超速离心是最常用的技术,但它的使用存在一些问题。反复多轮的超速离心会破坏sEV的结构和生物学完整性,导致EV聚集、非EV颗粒或蛋白质污染,产生的sEV产量低下。这可能会影响下游应用和研究,包括对sEV组成和结构的分析。超速离心的缺点促使学术界和工业界的研究人员采用温和的分离方法,因此人们开始偏向使用切向流过滤和尺寸排阻色谱。切向流过滤是一种利用错流过滤原理浓缩和过滤颗粒的系统。通常,超滤装置使用死端过滤,其中介质垂直于膜进行施加,一次通过整个体积,这可能会出现膜渗透性降低并导致操作时间增加和效率低下的情况。相比之下,切向流过滤将介质平行于膜并从中通过,防止分子积累和膜污染,直到整个体积都流入完毕。由于其温和的性质和效率,尺寸排阻色谱的应用在世界各地的实验室中很普遍。切向流过滤与尺寸排阻色谱结合能够保持 EV 完整性和防止 EV 聚集,可以预期这种组合方法可能在不久的将来成为许多实验室的标准。在这项研究里,研究人员对基于切向流过滤和随后的尺寸排阻色谱法,从含血清培养基中生长的细胞中分离sEV,对优化方案进行了完整分析。研究人员全面评估了使用切向流过滤和尺寸排阻色谱法从各种人和鼠癌细胞系(包括 HeLa、MDA-MB-231、EO771和 B16F10)中分离sEV的方案。由于超速离心和尺寸排阻色谱的结合是 EV 研究人员常用的技术,因此研究人员对切向流过滤与超速离心方法进行了严格的比较,基于不同细胞系和物种的产量、纯度、质量、特异性、成本、时间要求和重现性等因素。超速离心和切向流过滤表现出一致的 sEV种群,具有相似尺寸分布的颗粒,最高可达200 nm。然而,切向流过滤在分离sEV产量方面超过了超速离心,使其更适合大规模研究应用。这项结果表明,切向流过滤是一种可靠且稳健的sEV分离方法,在产量、重现性、时间、成本和可扩展性方面都超过了超速离心,这些优势有助于综合研究应用和下游产业开发。参考文献: Comparative analysis of tangential flow filtration and ultracentrifugation, both combined with subsequent size exclusion chromatography, for the isolation of small extracellular vesicles. J Extracell Vesicles. 2022;11(9):e12266.




