先天性免疫对各种入侵的病原微生物能快速反应,同时在特异性免疫的启动和效应过程也起着重要作用。Toll样受体(Toll-like receptors, TLRs)在细胞表面和胞内体中识别病原微生物的产物,诱导NFkB / IRF3介导的转录反应。细胞质中的第二组受体识别相同病原微生物的产物,但触发明显不同的反应,激活关键的炎症小体。最新一种细胞质中的免疫监视机制是一类新的脂多糖(LPS)介导的途径。之前的研究认为LPS仅由细胞表面的TLR4识别,导致基因表达的转录调控。最近的研究发现,宿主能够在细胞质中通过TLR4非依赖的途径识别LPS。小鼠炎性caspases-11和人类的caspase-4和caspase-5被认为是LPS的胞质受体。caspases-11结合胞质LPS导致其自身的活化,与NLRP3和ASC一起激活caspases-1。细胞质LPS产生的反应与细胞外LPS依赖TLR4的识别反应不同,因此LPS进入细胞质是一个重要事件。
革兰氏阴性细菌分泌直径为20-250纳米的胞外膜泡(outer membrane vesicles, OMVs)。OMVs并不是细菌细胞壁损坏或裂解产生的副产品,而是细胞程序性产生的真正的分泌膜泡。脂多糖LPS是OMVs最丰富的组成部分之一。细菌在压力的条件下,如宿主环境中,OMVs的分泌水平增加,OMVs使得细菌与宿主细胞间进行沟通,并传递病原微生物的产物以调节宿主细胞的功能。因此,OMVs类似于真核生物的外泌体/微泡,是一种有效的细胞间通信机制。以往的研究表明,纯化的OMVs可激活免疫反应,以及OMVs相关的肽聚糖激活NOD信号和NF-kB。此外,由肠道菌群产生的OMVs发挥黏膜免疫免疫调节作用。因此,OMVs促进病原微生物和宿主间的交流。
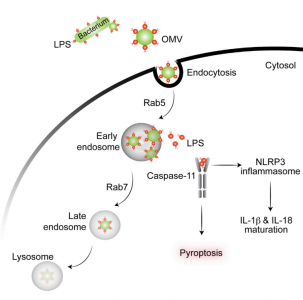
胞质溶胶中的脂多糖(LPS)可激活caspase-11,并且对宿主防御革兰氏阴性细菌感染和败血症的发病极为重要。但是,能激活caspase-11的大多数革兰氏阴性细菌并不进入胞质,这些细菌来源的LPS是通过何种途径接触到在细胞质中的caspase-11 的仍不清楚。来自康涅狄格大学的研究人员发现革兰氏阴性细菌产生的细胞外膜泡(outer membrane vesicles, OMVs)可作为载体递送LPS进入宿主细胞质,在体外和体内实验中触发caspase-11依赖性免疫反应。OMVs通过内吞作用进入宿主细胞质,LPS从早期胞内体释放进入细胞质。使用OMVs生成能力被严重削弱的hypovesiculating细菌突变体,揭示了OMVs在介导LPS到胞质的重要性。总的来说,该研究结果表明OMVs在革兰氏阴性细菌感染过程中传递LPS至宿主胞质然后活化caspase-11的关键作用。
该研究的亮点:
- 细菌分泌的OMVs将LPS传递到宿主细胞质内
- OMVs激活caspase-11介导的胞浆内LPS的感知
- OMVs通过内吞作用进入细胞,LPS从早期胞内体进入细胞浆
- OMVs在细菌感染过程中激活caspase-11是必需的
参考文献:
Vanaja S K, Russo A J, Behl B, et al. Bacterial Outer Membrane Vesicles Mediate Cytosolic Localization of LPS and Caspase-11 Activation[J]. Cell, 2016.