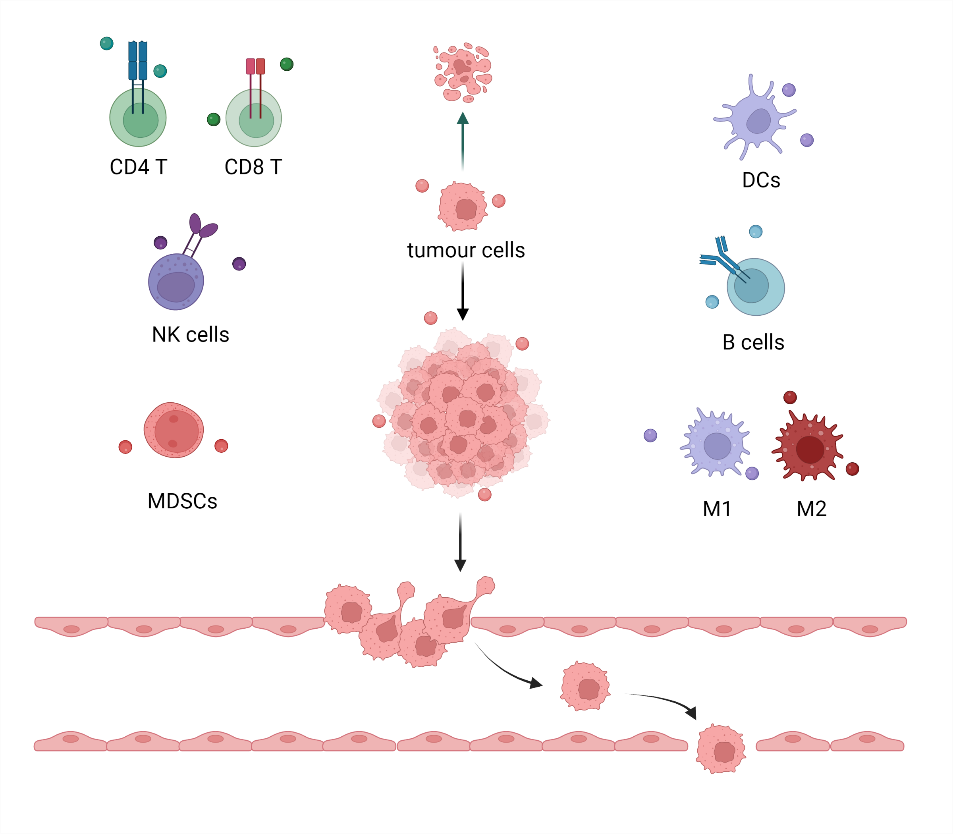
小细胞外囊泡(small extracellular vesicles,sEVs)特指直径为50-150nm的细胞外囊泡(extracellular vesicles,EVs),根据不同的生物发生途径,sEVs可分为内体来源的“exosomes”以及质膜来源的“ectosomes”和“microvesicles”。数量庞大的sEVs携带着各种生物大分子,介导细胞间交流。肿瘤环境中充斥着肿瘤细胞和免疫细胞来源的sEVs。肿瘤细胞来源的sEVs(tumour derived sEVs,TDsEVs)能够通过多种机制促进肿瘤的发生发展,而包括T细胞、B细胞、树突状细胞(DCs)、自然杀伤(NK)细胞、骨髓源性抑制性细胞(MDSCs)在内的多种免疫细胞所分泌的sEVs则根据其性质的不同,发挥着促肿瘤或抗肿瘤的免疫效应。基于此,肿瘤环境中的sEVs在癌症诊断和治疗方面都有着巨大潜力。肿瘤细胞来源的sEVs携带着丰富的蛋白质和核酸等,可以作为癌症特异性的诊断标志物,目前已经开展了多项临床试验。而在癌症治疗方面,已经有大量的研究致力于利用工程化手段改造各种细胞来源的sEVs,包括通过物理化学方法使其携带化学治疗和基因治疗药物,通过基因工程改造使其表达靶向性蛋白、免疫杀伤效应分子等。结合sEVs天然的生物学特性,工程化的sEVs具备良好的靶向性和相容性,往往增强了传统癌症疗法的抗肿瘤效应和安全性。
近期,海军军医大学(原第二军医大学)胡适课题组在J Exp Clin Cancer Res杂志上发表了题为“The roles of small extracellular vesicles in cancer and immune regulation and translational potential in cancer therapy”的综述文章(DOI:10.1186/s13046-022-02492-1),梳理和总结了肿瘤环境中sEVs促肿瘤及抗肿瘤的免疫学机制,以及将sEVs用于癌症诊断和治疗的研究进展。硕士研究生钱珂文为论文的第一作者。
在复杂的肿瘤环境中,肿瘤细胞来源的sEVs(TDsEVs)通过多种机制促进肿瘤的恶性进展,包括破坏上皮细胞间紧密连接,促进血管再生,并参与肿瘤转移前微环境的形成;诱导上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)过程,增强干细胞特性;抑制免疫细胞的杀伤功能或诱导免疫抑制性细胞的增殖;激活肿瘤细胞的抗凋亡信号通路和药物抵抗。总得来说,TDsEVs在肿瘤微环境的重塑中发挥重要作用。而各种免疫细胞来源的sEVs则通过直接与肿瘤细胞接触或调节其他免疫细胞,直接或间接地调节整个免疫系统。以T细胞为例,其分泌的sEVs同样携带着决定T细胞免疫效应的共刺激分子、细胞因子受体、MHC分子等。因此,活化T细胞能够分泌大量的sEVs,激活杀伤性T细胞、杀伤肿瘤细胞和调节DC功能等。
图1. 肿瘤环境中的sEVs针对于sEVs在癌症诊断和治疗中的应用,一方面可以获取未经改造的sEVs,指示疾病变化或制备天然的免疫激活剂,另一方面也可对sEVs进行工程化改造,赋予其更为广阔的抗癌效应。TDsEVs携带着丰富的蛋白质和核酸信息,能够代表分子水平上肿瘤细胞的致癌性变化,且可以在多种体液中获取,因此已经有大量的研究和临床试验将其用于区分癌症的进展和分期。这些肿瘤特异性的标志物除了可用于诊断外,还可作为免疫原性分子,激活免疫反应。将sEVs作为药物载体用于癌症治疗则是另一个广受关注的研究方向。sEVs具有优秀的天然特性,如良好的生物相容性、组织渗透性等,此外,sEVs具有广阔的工程化改造空间,可以将其用于化学治疗、基因治疗、光热和光动力治疗、免疫治疗等多种传统的癌症疗法。目前来说,主要研究思路是在其内部装载效应性治疗物质,如化学药物、基因编辑工具、光热剂和光敏剂的同时,赋予sEVs靶向特性,使其表达组织特异性配体,靶向肿瘤部位。在免疫治疗方面,工程化免疫细胞来源的sEVs往往同时携带着免疫细胞本身以及研究者感兴趣的效应分子,而基于其天然特性,这一类sEVs有潜力解决目前细胞治疗存在的问题,成为细胞治疗的辅助或替代疗法。例如,在CAR-T治疗中,尚存在脱靶效应引发细胞因子风暴,以及限制其广泛应用的肿瘤浸润难和细胞耗竭等问题。作者所在课题组前期制备了EGFR或HER2特异性CAR-T细胞来源的外泌体,该外泌体表达有EGFR或HER2特异性的CAR。体外和体内实验结果表明,类似于CAR-T细胞的生物学效应,CAR外泌体具有良好的靶向性和肿瘤杀伤特性,而值得注意的是,CAR外泌体不表达PD-1,因此不同于直接使用CAR-T细胞,CAR外泌体不受PD-1 / PD-L1介导的免疫抑制的影响,此外,体内实验中未观察到细胞因子风暴等不良反应。
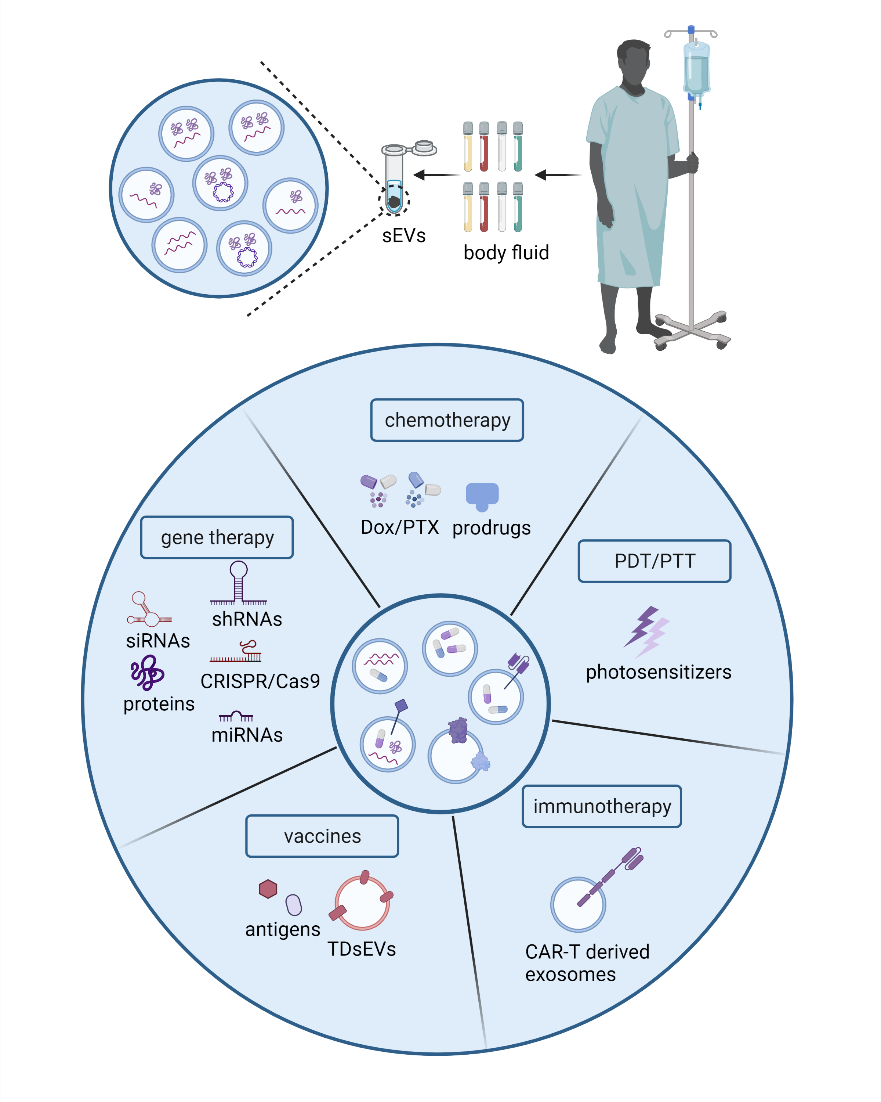
图2. sEVs在癌症诊断和治疗中的应用胡适团队长期从事合成免疫治疗新技术的研发工作,近年来在Nat Biomed Eng,Nat Commun,Clin Cancer Res等国际权威期刊持续发表系列研究成果。在外泌体研究方面,课题组聚焦于免疫细胞来源小细胞外囊泡的人工合成改造及应用研究探索。参考文献:The roles of small extracellular vesicles in cancer and immune regulation and translational potential in cancer therapy, J Exp Clin Cancer Res. 2022 Sep 27;41(1):286. doi: 10.1186/s13046-022-02492-1.
外泌体资讯网 J Exp Clin Cancer Res | 海军军医大学胡适团队发表综述:小细胞外囊泡的肿瘤免疫调控作用及其工程化应用