受生物学、制药科学和纳米工程技术的启发,近几十年来开发了许多靶向药物递送系统。但这些系统由于靶向效率受限、细胞毒性、易被清除性和不稳定性,靶向效果差强人意。因此,天然内源性货运载体—细胞外囊泡(EVs)因其独特的固有靶向特性、生物相容性、跨膜能力和循环稳定性引起了研究人员的极大兴趣。EVs膜上富集与靶细胞相互作用的受体或配体,赋予它们固有的靶向使命。然而,大多数天然治疗性EVs面临被巨噬细胞清除的命运,导致脱靶。所以,EVs递送系统的特异性亟待进一步提高。
近日,来自山西医科大学口腔医学院王兴课题组的研究人员在Journal of Nanobiotechnology(中科院1区,IF=9.429)杂志上发表题为“Nanoengineering facilitating the target mission: targeted extracellular vesicles delivery systems design”的综述(doi: 10.1186/s12951-022-01638-9.),全面总结了1. EVs 固有的归巢机制以及供体细胞来源和给药途径等影响靶向任务的所有因素;2.修饰EVs 以改善特异性靶向的纳米工程技术,例如针对供体细胞的改变和 EV 表面的修饰;3.通过改变外部环境(例如磁性和光热)来提高特异性的辅助策略,讨论了诸如缺乏评估目标效率的金标准等问题。这篇综述将为精准药物输送系统的发展提供新的见解。宋皓月,陈小杭为该综述的共同第一作者,王兴教授为通讯作者。
细胞外囊泡(EV),50–1000 nm,在近距离和远距离细胞间通讯中均可发挥作用,是我们体内天然的货物载体。由于分离技术受限,EV目前可被分离为外泌体,微囊泡和其他EV亚群,它们在尺寸,生产方式和内容物上均有所不同。研究人员基于以下几个特征将EV作为药物递送工具:(1)良好的生物相容性和低免疫力;(2)内部囊泡结构提供载药空间并且可保护内容物免受循环组织液降解;(3)EV外部的磷脂双分子层允许EV穿越组织屏障(99%的分子都会被阻挡在外);(4)EV膜上的蛋白,脂质和聚糖能提供天然修饰位点,可赋予EV靶向性能。如果可以进一步提高目标特异性,预计EV可成为弥补当前靶向药物递送系统缺陷的里程碑式的一步。因此,探索其归巢任务并开发解决方案以提高其靶向能力势在必行。EV完成靶向任务主要依赖于EV表面富集的结构,例如受体-配体蛋白。EVs表面富集有许多受体或配体,这些受体或配体对靶细胞表面大量表达的受体具有天然的亲和力,这有利于EV的靶向(如图1所示)。治疗药物或核酸分子被释放到细胞外基质后使用 EVs 作为运输工具将它们分布到各个组织或器官中。大量研究表明,释放的 EVs 倾向于将特定分子传递给亲代细胞,这有助于 EV 归巢。然而,由于并非所有 EV 都靶向供体细胞,因此研究人员需要对其供体细胞进行慎重选择。 此外,不同的递送方式也会影响EVs的分布,了解这些特性有助于减少不良影响并提高EV的生物利用(如图2所示)。
图1:EV的天然靶向机制
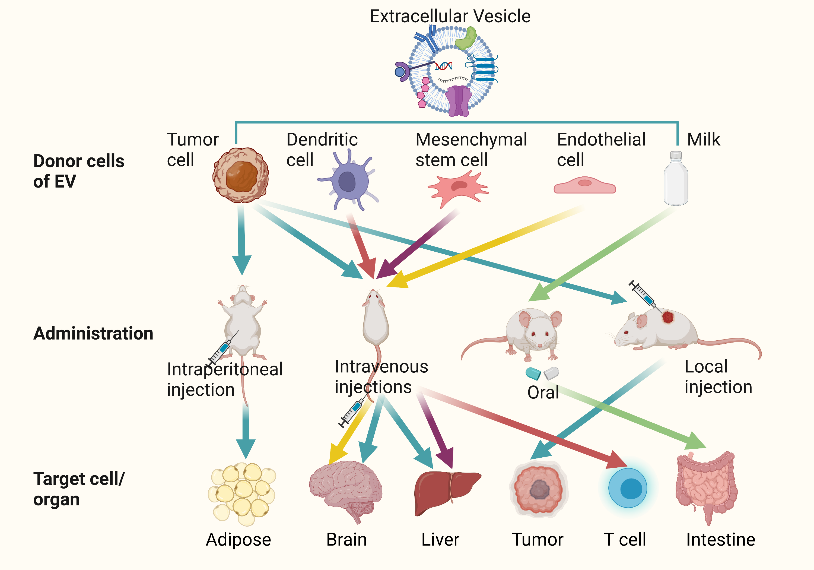
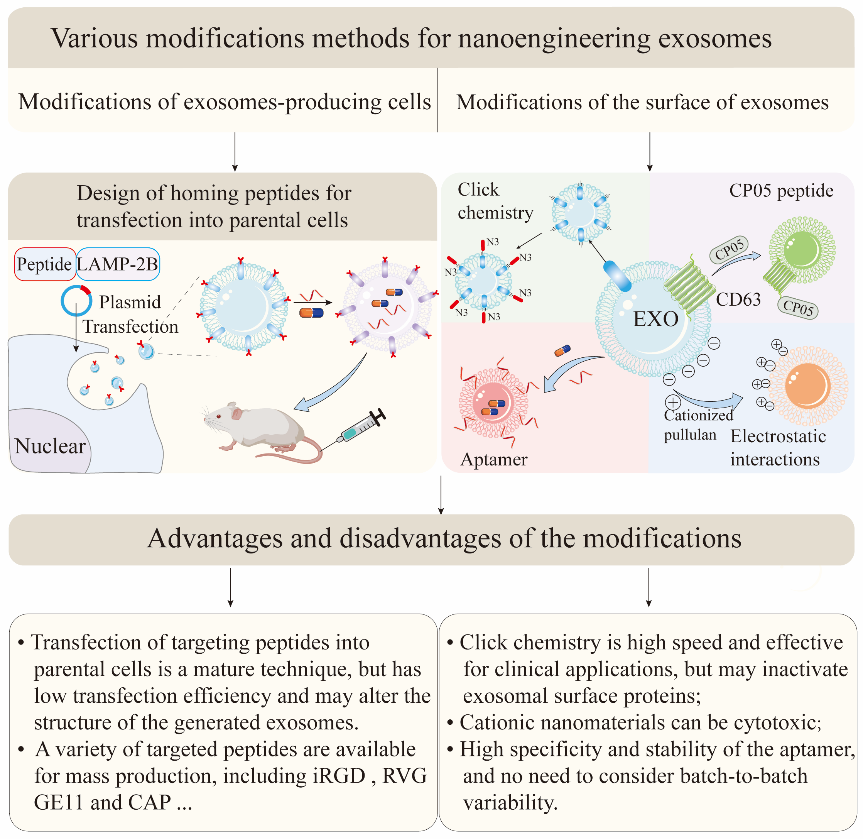
图2:EV靶向特定细胞或组织的方式然而,EV表面分子,细胞起源和给药方式都不足以应对复杂的体内微环境。纳米工程化EVs应运而生。纳米工程化的EVs是指那些对EVs亲本细胞或者直接对EVs本身进行修饰后产生的EVs。例如,在EVs表面呈现嵌套多肽或抗体片段以获得靶向EV,以及直接修饰EVs表面,包括点击化学和开发一种称为“cloaking”的膜锚定平台,以促进靶细胞的摄取。我们进一步比较了不同的纳米工程电动汽车策略(如图3所示)。此外,还可以利用外部辅助策略(包括磁效应,光热效应,超声效应)增加EVs在损伤组织中的积累,降低EVs的脱靶效应,避免对正常组织的损伤。
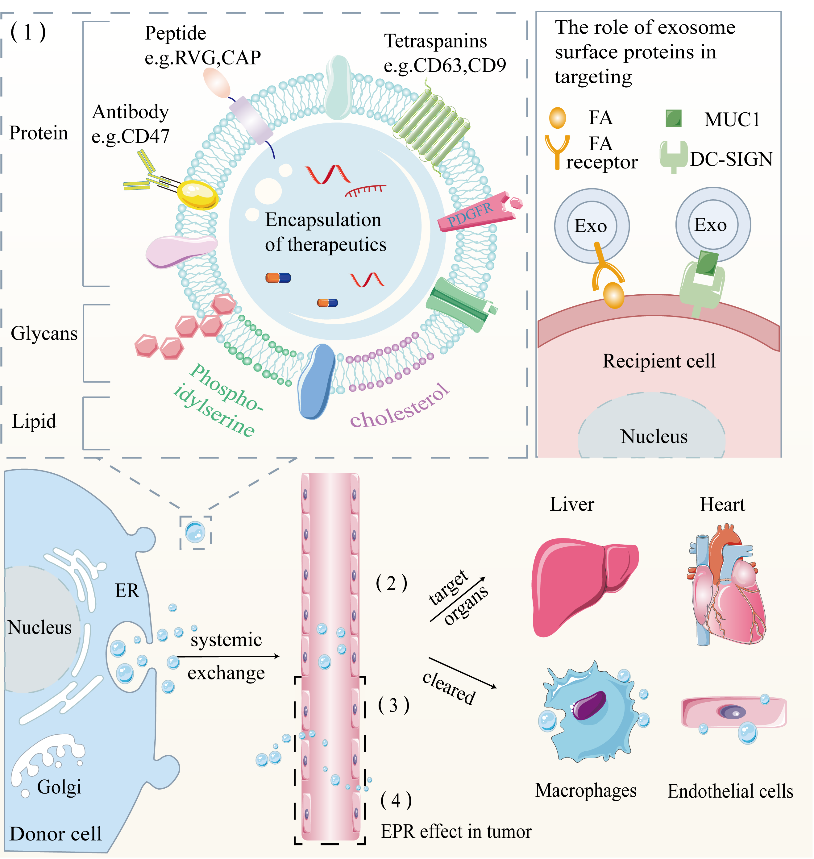
图3:纳米工程化EV 的修饰策略和特性尽管取得了这些令人鼓舞的成就,但EVs在靶向递送平台上的应用仍存在一些障碍。因此,仍需要更先进的方法来扩大EVs在靶向治疗中的潜力。在未来,我们期望通过多学科的努力,实现质量可控的靶向EVs的规模化生产,并打破靶向治疗中EVs的治疗瓶颈。参考文献:Nanoengineering facilitating the target mission: targeted extracellular vesicles delivery systems design. J Nanobiotechnology.2022;20(1):431.
外泌体资讯网 J Nanobiotechnology |山西医科大学口腔医学院王兴团队:纳米工程促进目标任务:细胞外囊泡靶向递送系统设计