近日,Codiak BioSciences公司宣布了其泛β冠状病毒疫苗计划的更多临床前数据,该计划旨在防止所有受关注的SARS-CoV-2变体和属于β冠状病毒家族的潜在未来毒株。这些数据近日在华盛顿特区举行的2022年疫苗峰会上的演示文稿和海报中公开,展示了Codiak的exoVACC™候选疫苗exoRBD预防多种已知的SARS-CoV-2关注变体(VoC)和7种来自Sarbecovirus家族的冠状病毒的潜力,Sarbecovirus目前存在于蝙蝠体内,并且很可能会传染给人类。
“针对SARS-CoV-2的疫苗和治疗开发已有不错的进展并挽救了生命,但该病毒继续变异以逃避疫苗保护。同时,仍然存在可能出现另一种Beta冠状病毒或令人担忧的变体的威胁。”Codiak首席科学官Sriram Sathyanarayanan博士说,“很明显,一种对一系列冠状病毒提供全面免疫的疫苗将解决这一紧迫需求,并代表着在对抗这些病毒方面取得了重要进展。基于我们过去一年的体内结果表明,我们的泛β-冠状病毒候选疫苗的二价版本对已知的SARS-CoV-2毒株提供广泛的保护性免疫,并具有保护对抗循环的蝙蝠冠状病毒,这种冠状病毒可能很有可能将人畜共患病传播给人类。这表明我们基于外泌体的疫苗可能会限制病毒变异和逃避保护的能力。我们期待与为这项研究提供资金的流行病防范创新联盟(CEPI)继续合作,并计划将我们的二价exoRBD候选者推进IND支持研究。”
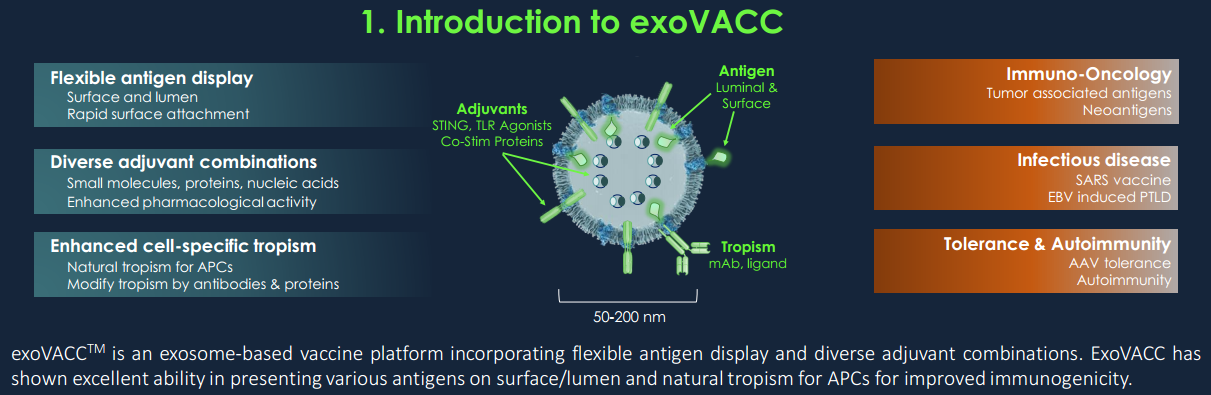
Codiak的泛β冠状病毒候选疫苗结合了多种不同的特征来产生全面的免疫,特别是使用来自冠状病毒的受体结合域(RBD)分子来提供广泛的抗体保护和整合高度保守的T细胞表位,从而引发强大的CD8 T细胞反应抗突变压力。
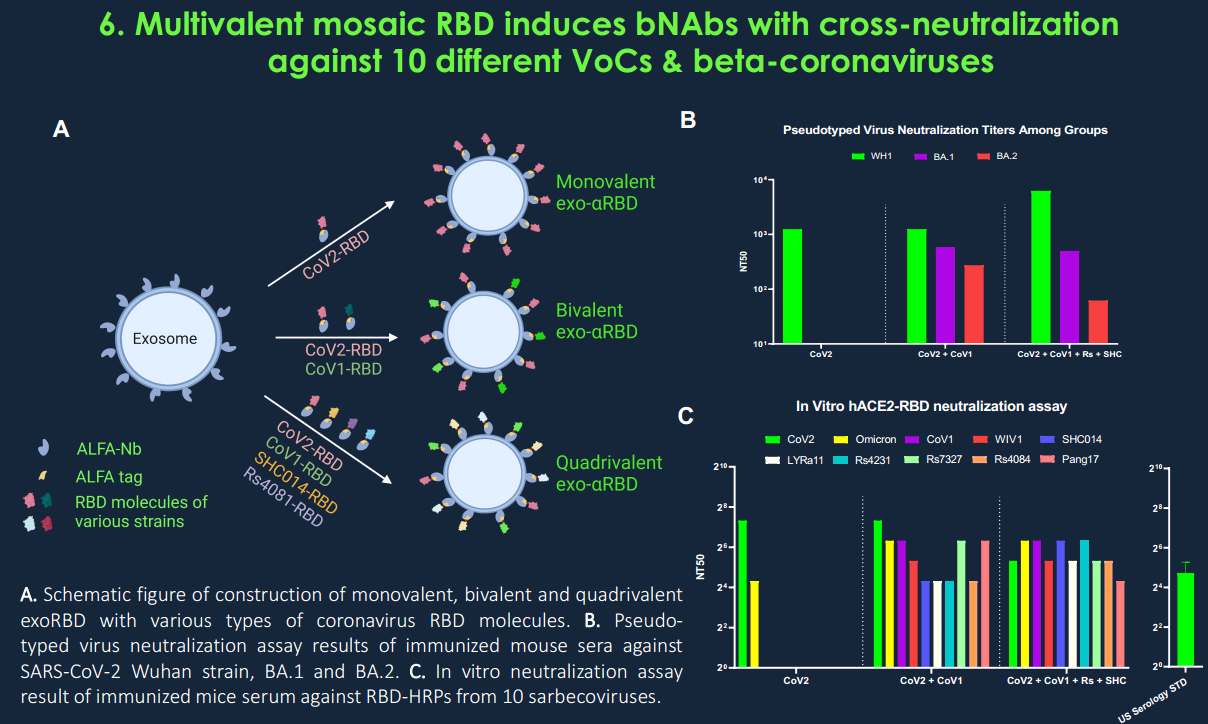
- Codiak的泛β冠状病毒疫苗的二价版本含有来自SARS-CoV-2(Wu)和SARS-CoV-1的RBD,在体内产生了针对多种SARS-CoV-2变体和七种蝙蝠冠状病毒的保护性免疫,包括密切相关的穿山甲病毒;
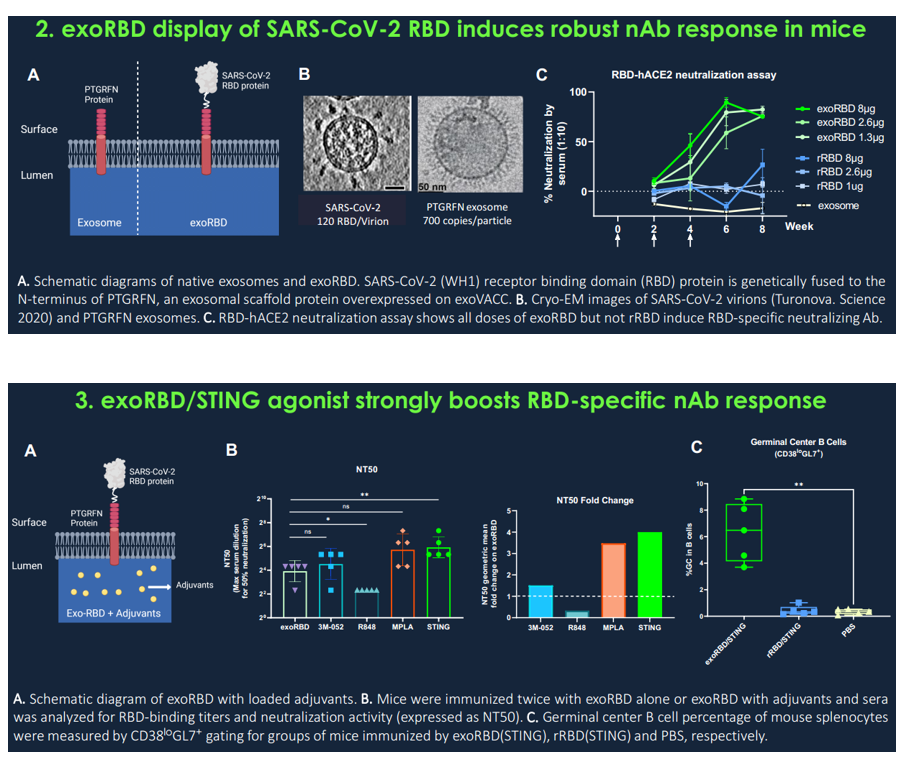
- SARS-CoV-2 RBD在外泌体上的多价展示诱导了比可溶形式的rRBD更高滴度的抗RBD抗体和更强的中和效力,突出了外泌体表面展示的重要性;
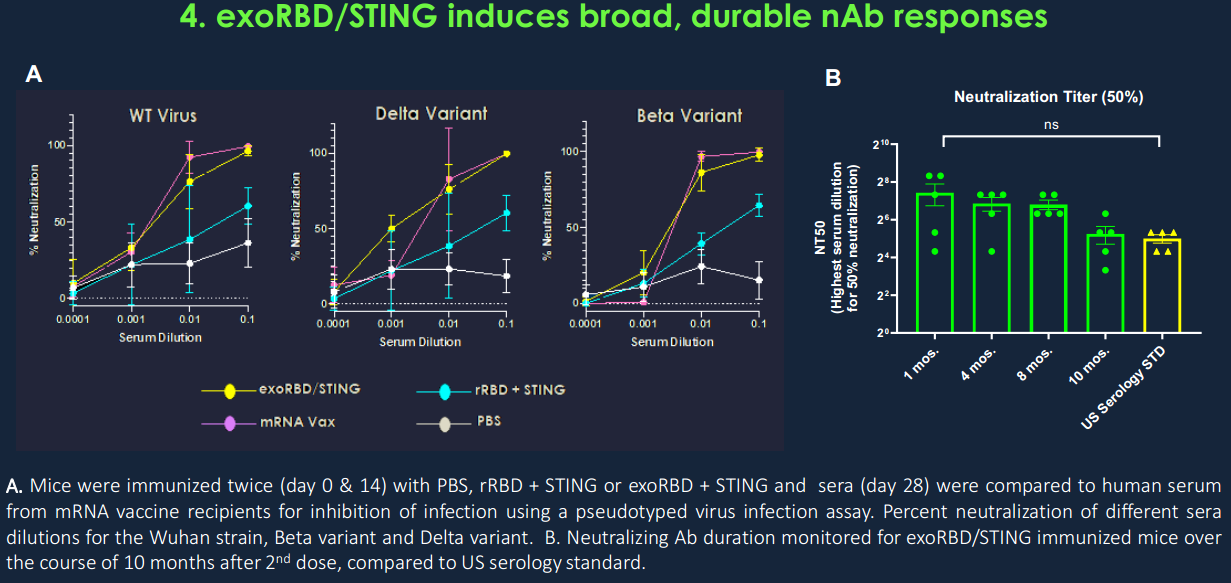
- 将STING激动剂加载到exoRBD上可强烈增强RBD特异性抗体反应,其中和抗体水平与接种两次mRNA疫苗的人类受试者相似,抗体反应可持续10个月或更长时间;
- 在基于外泌体的疫苗中添加T细胞抗原可引发CD8+ T细胞对保守T细胞表位的反应,这些表位提供粘膜免疫,从而在致命的SARS-CoV-2攻击后提供最大程度的保护和减少肺部炎症。
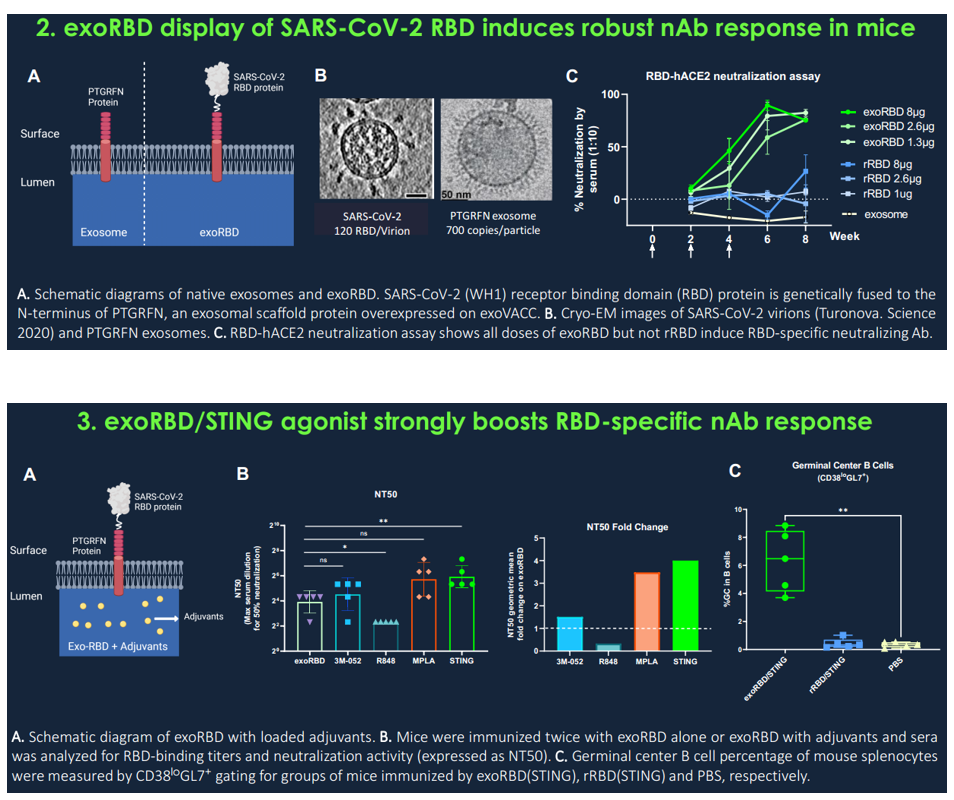
Codiak的专有和模块化疫苗平台exoVACC利用工程外泌体(天然存在的细胞外纳米囊泡)来精确控制抗原在表面或腔内的展示,以便同时选择性地将抗原、佐剂和免疫调节剂递送至抗原呈递细胞最大化免疫反应。与美国麻省总医院、麻省理工学院和哈佛大学的Ragon研究所合作开发的泛β冠状病毒疫苗构建体在外泌体表面高密度携带SARS-CoV-1和SARS-CoV-2的受体结合域(RBD)蛋白,结合在腔内表达的结构受限、高度保守的T细胞抗原,以及作为佐剂的STING激动剂的稳定负载。这种设计与天然病毒结构非常相似,并且可以修改为多种给药途径,包括皮下、肌内和鼻内。
资料来源:Codiak