光动力疗法(PDT)是一种很有前途的无创治疗方法,它利用光敏剂(PS)产生高活性氧(ROS),包括单重态氧,促进靶细胞凋亡。PDT已被证明对多种疾病有效,包括癌症、心血管疾病、炎症性肠病和糖尿病眼病。然而,PDT的治疗效果有限,常常伴有副作用,主要是由于PSs的非特异性递送偏离了预期的损伤部位。在过去十年中,尽管开发的各种纳米药物输送系统在降低PSs的靶外效应的同时显著提高了治疗效果,但人们对静脉注射后合成纳米材料的安全性和毒性的担忧仍在增加。细胞外囊泡(EVs)是一种从细胞中释放出来的天然纳米颗粒,由于EVs与其他纳米颗粒相比具有潜在的低免疫原性和生物相容性,EVs正在成为PSs的新型药物传递系统。2022年9月27日,山东第一医科大学徐涛院士团队仝令君博士和新加坡国立大学医学院王炯伟教授合作在Front Bioeng. Biotechnol在线发表了题为“Extracellular vesicles as a novel photosensitive drug delivery system for enhanced photodynamic therapy”的综述论文(doi: 10.3389/fbioe.2022.1032318)。该综述旨在概述PSs递送系统的研究进展,并提出EVs作为新型PSs递送系统的优势,为有效提高PDT精准靶向临床治疗提供新思路。山东第一医科大学医学转化中心仝令君副研究员、黄蓉研究员为共同通讯作者。该研究受到山东第一医科大学院士工作站基金、新加坡国立大学NanoNASH项目支持。
PDT在治疗癌症、胃肠道疾病、心血管疾病和糖尿病方面已显示出临床疗效。然而,由于PSs靶向性差,PDT的治疗效果受到局部和全身毒性的限制。使用表面修饰或纳米递送系统设计的新一代PSs具有增强靶向性和减少非靶向副作用等优势。然而,传统的纳米系统由于其合成材料而引起了某些安全性问题。EVs作为细胞分泌的天然纳米粒子,由于其固有的归巢特性和较低的免疫原性,近年来被广泛用于药物递送。对于PSs的输送,肿瘤衍生EVs显示出明显的“归巢”特性,可以增加PSs在肿瘤部位的聚集,增强抗肿瘤作用。另一方面,用于PSs递送的免疫细胞衍生EVs在PDT中表现出显著的协同效应。原则上,鉴于EVs较低的免疫原性,将使其递送引起的不良免疫反应最小化,从而促进基于EVs递送PSs的开发。然而,关于EVs作为PSs递送载体在PDT治疗中的研究仍然很少。主要原因是EVs生物发生、分离和纯化的复杂性。对于细胞来源的EVs,细胞培养条件(包括细胞密度和细胞传代)显著影响EVs的产量、组成和生物活性。来自牛奶等生物流体的EVs和来自植物的可食用EVs含有丰富的脂蛋白和可溶性脂蛋白颗粒,从而增加了EVs分离和纯化的复杂性。尽管EVs用于PSs递送的临床转化面临着各种挑战,例如大规模生产和纯化。然而,EVs仍是新一代最有潜力的PSs递送系统,用于更有效、更安全的PDT治疗。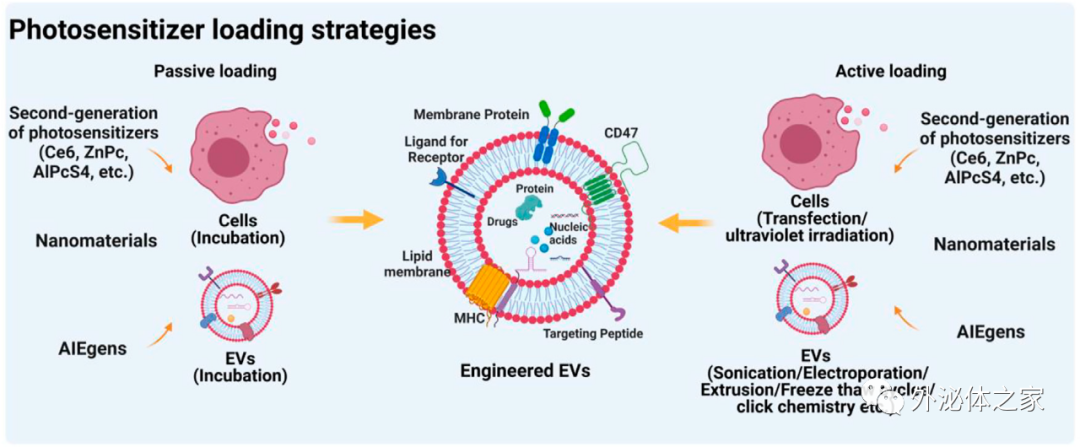
Extracellular vesicles as a novel photosensitive drug delivery system for enhanced photodynamic therapy. Front. Bioeng. Biotechnol. doi: 10.3389/fbioe.2022.1032318外泌体资讯网 Front Bioeng. Biotechnol.|山东第一医科大学/新加坡国立大学:细胞外囊泡作为新型光敏剂载体增强光动力疗法