雌性哺乳动物在出生便具有有限数量的原始卵泡,这些原始卵泡在形成后大多处于休眠状态并随着年龄的增长而逐渐消耗。卵巢功能取决于原始卵泡库,而原始卵泡的激活速率决定了雌性的生殖寿命。然而,在生理条件下原始卵泡的激活并不是随机的,人们对于卵巢储备下降的机制也知之甚少。那么在漫长的生殖寿命中原始卵泡是怎样被逐渐激活的机制目前仍不清楚。近日,南京医科大学生殖医学国家重点实验室李晶团队在Clinical and Translational Medicine 杂志上在线发表了题为“Macrophage‐derived extracellular vesicles regulate follicular activation and improve ovarian function in old mice by modulating local environment”的研究论文 (2022 Oct;12(10):e1071)。该研究揭示了在卵巢周期中原始卵泡选择性激活的新机制,同时探讨了巨噬细胞来源的细胞外囊泡通过调节衰老卵巢的免疫微环境对于衰老卵巢功能的调节。南京医科大学生殖医学国家重点实验室李晶教授、华中科技大学同济医学院计划生育研究所相文佩教授、先声药业转化医学与创新药物国家重点实验室吴庭鹤研究员为该研究的共同通讯作者,南京医科大学生殖医学国家重点实验室博士研究生肖月和硕士研究生彭晓旭为该研究的共同第一作者。
在这项研究中,研究人员使用超排小鼠和自然排卵小鼠模型证明了排卵诱导的局部炎症是每个动情周期中原始卵泡选择性激活的驱动因素。同时,这一发现与巨噬细胞在排卵卵泡中的浸润和卵巢中两种极化类型的巨噬细胞M1和M2型巨噬细胞(M1φ, M2φ)的动态变化有关。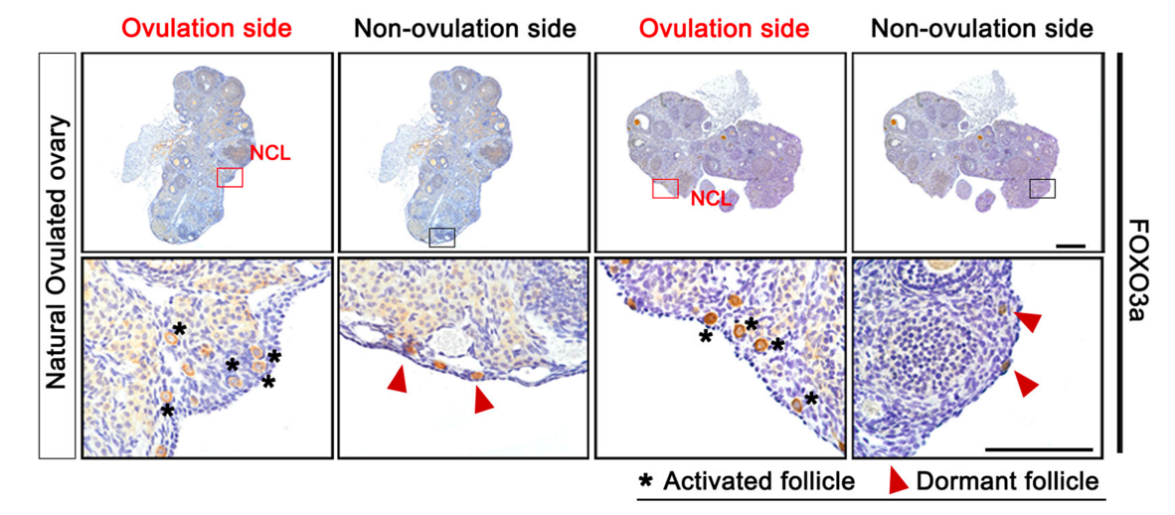
图1:自然排卵的卵巢:排卵点周围的原始卵泡多处于激活状态(FOXO3a信号定位于卵母细胞胞质),而非排卵侧的原始卵泡多处于休眠状态(FOXO3a信号定位于卵母细胞核内)。为了探究巨噬细胞动态变化对于卵泡激活的影响,研究人员在体外将不同亚型的巨噬细胞M1φ,M2φ分别与新生小鼠卵巢共培养。培养后表发现M1φ对原始卵泡具有激活作用,而M2φ则倾向将卵泡维持在休眠状态,其潜在机制与巨噬细胞分泌的细胞外囊泡(EVs)中含有的特定miRNAs: miR-107(M1)和miR-99a-5p(M2)对卵巢中PI3K/mTOR信号通路的差异调节有关。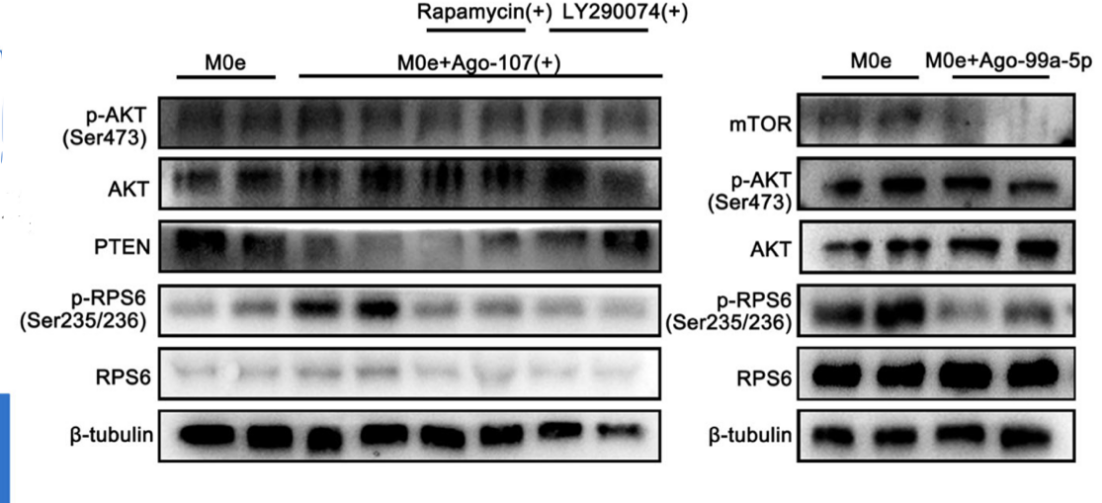
图2: M1和M2型巨噬细胞外囊泡内特定的miRNAs: miR-107和miR-99a-5p对卵巢内PI3K/mTOR相关信号通路的调节。卵巢衰老的特征表现为卵巢内的慢性低度炎症、原始卵泡库的加速耗竭和卵母细胞质量的下降。基于M1φ和M2φ在卵巢中的差异的动态变化,研究人员进一步探究M1φ和M2φ在卵巢衰老过程中的参与和影响。通过尾静脉分别将M1和M2型巨噬细胞来源的细胞外囊泡(M1-EVs, M2-EVs)注射到衰老雌鼠体内。治疗后发现接受M2-EVs治疗的小鼠卵巢功能和卵子质量得到了提高并改善了卵巢内的炎性微环境。M1-EVs治疗后则加剧了卵巢的衰老程度。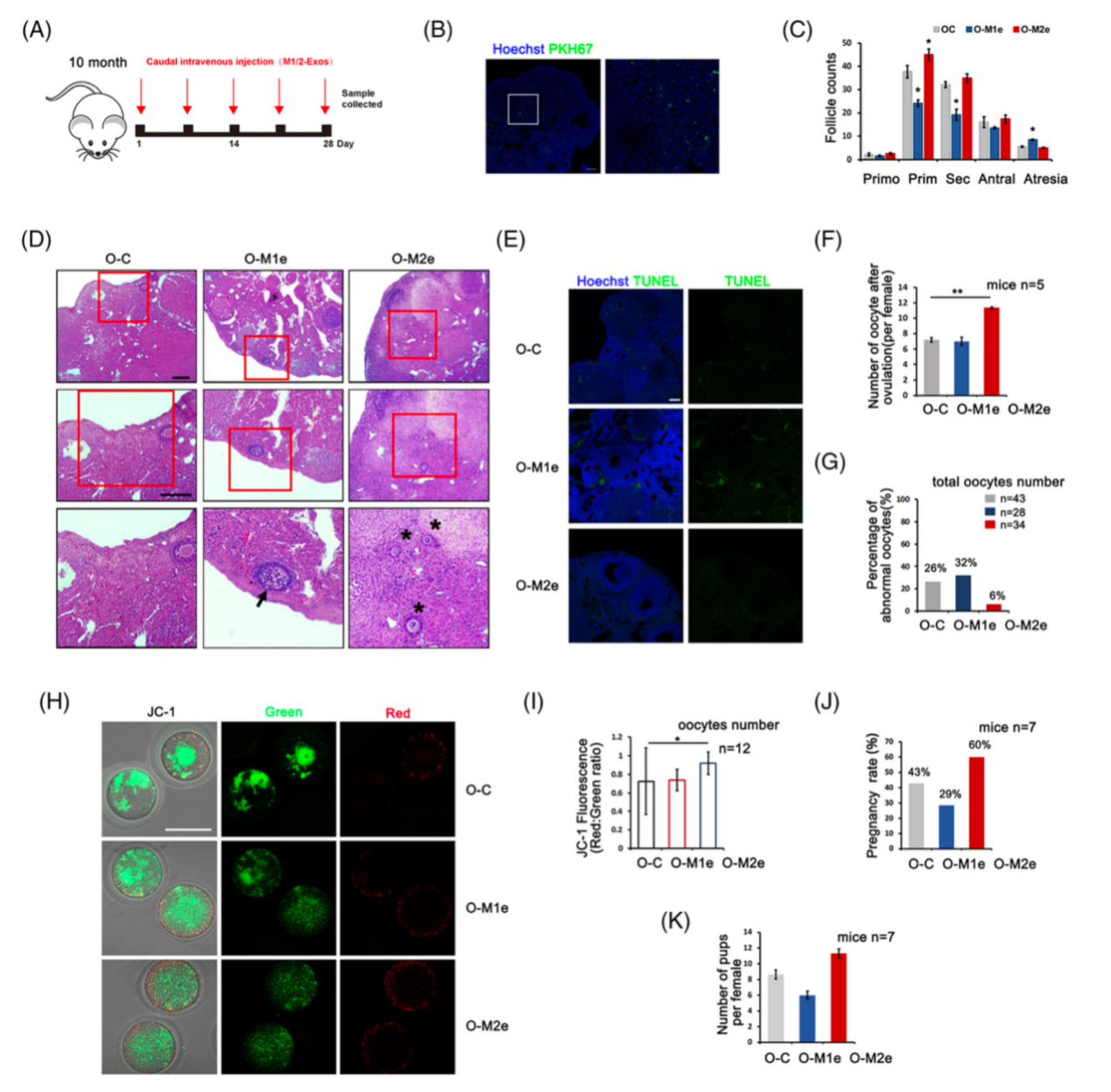
图3: 老年小鼠M2-EVs治疗后卵巢功能得到了改善。研究人员进一步评估了M2-EVs治疗后的卵巢内的炎性环境。发现M2-EVs处理后降低了衰老卵巢中促炎基因的表达。同时M2-EVs特有的抗炎miRNA通过下调mTOR信号通路降低了卵巢基质细胞的炎症。从而改善了卵巢内的炎症微环境。因而,M2-EVs可能有着适用于卵巢内抗炎的治疗的潜力。综上所述,该研究提出了一个排卵期间由循环的巨噬细胞动态变化诱导的原始卵泡选择性激活的新概念。不同亚型的巨噬细胞M1φ和M2φ通过其衍生的细胞外囊泡和特定的miRNAs对原始卵泡的激活有着差异性的调节。促炎性的M1φ的增加促进了衰老卵巢内的炎性微环境并加速了卵巢储备的消耗。最后通过M2-EVs的治疗有效的挽救了衰老卵巢的卵巢功能并改善了卵巢内的炎性微环境。基于M2-EVs在衰老卵巢中的抗衰能力,M2-EVs可能作为改善炎症相关不孕症的新的治疗策略。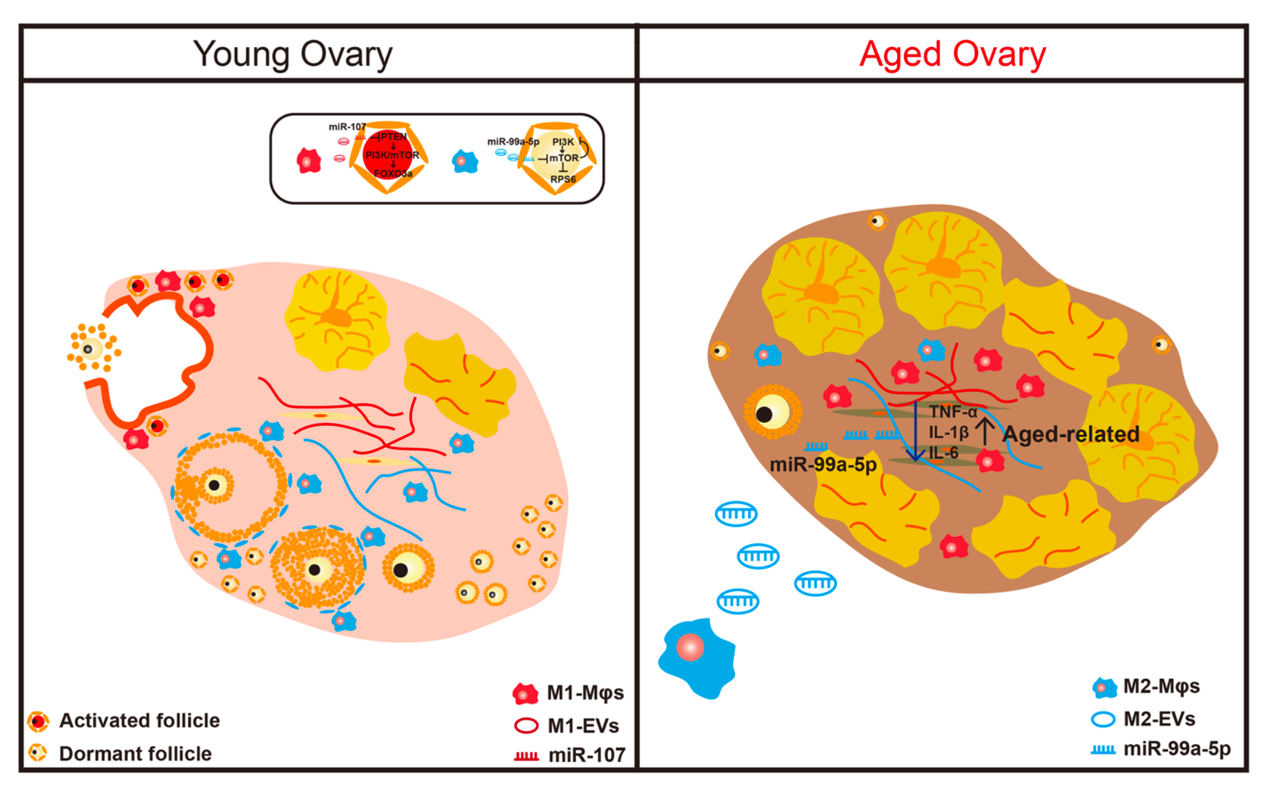
图4: 巨噬细胞在调节卵巢生理排卵后原始卵泡的激活和卵巢衰老过程中的炎性调节作用。Macrophage-derived extracellular vesicles regulate follicular activation and improve ovarian function in old mice by modulating local environment, ClinTranslMed. 2022Oct;12(10):e1071. doi: 10.1002/ctm2.1071.外泌体资讯网 ClinTransl Med | 南京医科大学李晶团队:巨噬细胞来源的细胞外囊泡调节衰老卵巢内炎性微环境