肿瘤来源细胞外囊泡(T-EVs)是肿瘤细胞释放的纳米级脂质膜囊泡,广泛存在于多种体液。作为细胞间通讯载体,T-EVs几乎参与肿瘤发生、发展的所有过程。例如,研究表明肿瘤细胞可释放PD-L1阳性EVs(T-EVPD-L1)进入肿瘤微环境和循环系统进行免疫逃逸。相比于其他液体活检靶标,T-EVs因丰度相对高、稳定性好,是目前较为理想的癌症诊断及免疫治疗疗效预测的标志物。然而,由于T-EVs的纳米级尺寸和表面标志物丰度低,且体液中富含蛋白和其他来源囊泡,高效、高选择地亲和分离T-EVs仍存在诸多挑战。
近日,上海交通大学医学院杨朝勇教授、吴玲玲副研究员团队发展了基于流动纳米孔微界面的跨尺度增强界面亲和反应新策略,实现对肿瘤细胞外囊泡的高效分离与灵敏检测。相关成果以“Fluid Nanoporous Microinterface Enables Multiscale-Enhanced Affinity Interaction for Tumor-Derived Extracellular Vesicle Detection”为题发表在国际期刊PNAS上(doi: 10.1073/pnas.2213236119.)。杨朝勇教授团队致力于发展体外诊断新方法、微流控技术在生物医学中的应用、单细胞分析、纳米生物医学工程、功能核酸探针等研究。近年来,该课题组发展了多种亲和界面构筑与调控新方法,成功实现体液中循环靶标富集与分析(http://www.yang-lab.com/),为液体活检提供了有力工具。
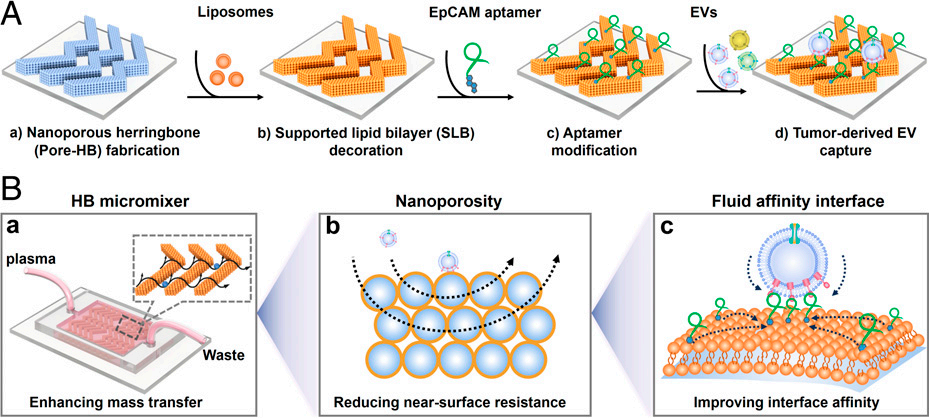
界面亲和反应包括三个重要过程:靶标-界面碰撞、识别分子与靶受体密接触、及亲和结合反应,其效率主要取决于界面理化性质。为了提高界面亲和反应效率,兼顾界面亲和反应的三个关键限制因素:传质、密接触、界面亲和力,该团队发展了基于流动纳米孔微界面(FluidporeFace)的跨尺度增强界面亲和反应新策略。该界面:1)在微米尺度,鱼骨微混合器促进T-EVs与亲和界面的高效传质与碰撞(图1B-a);2)在纳米尺度,纳米孔克服流体边界效应,增强T-EVs与界面的密接触(图1B-b);3)在分子水平,具有侧向流动性的识别分子可定向募集于结合位点,实现高亲和的多价结合(图1B-c)。通过协同增强传质、界面密接触和多价结合,跨尺度增强界面亲和反应效率。
图1. FluidporeFace构筑及其捕获T-EV示意图与常规适配体亲和界面相比,FluidporeFace界面亲和力提高了~83倍,实现了对多种体液中T-EVs的高效分离与灵敏检测,检测限(LOD)可低至10 EVs μL-1。在对多种临床样本(包括血浆、尿液及唾液样本)的检测中,癌症患者的T-EVPD-L1丰度均显著高于健康人,受试者工作曲线(ROC)(a.u.c = 1.00)表明了T-EVPD-L1作为癌症诊断指标的准确性接近100%。这些结果证实了T-EVPD-L1作为癌症诊断标志物的可行性及FluidporeFace-Chip的临床应用潜力。此外,该工作系统研究了界面流动性对界面亲和力及捕获性能的影响,为亲和界面构筑与改性提供了一种新思路。
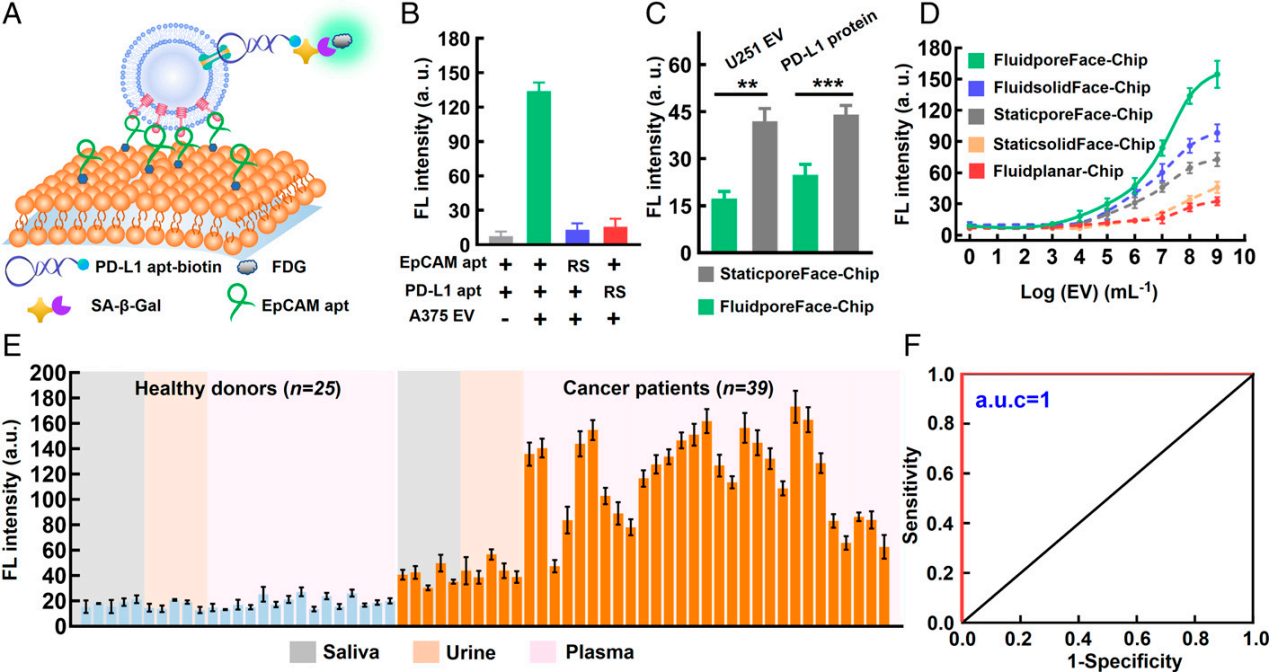
图2. 基于FluidporeFace-Chip的T-EVPD-L1检测该工作在厦门大学化学化工学院杨朝勇教授、上海交通大学分子医学研究院吴玲玲副研究员、张鹏研究员、浙江理工大学化学系崔亮的共同指导下完成。研究工作得到国家自然科学基金(22004083、21927806、21735004、22004084)、国家重点研发计划(2019YFA0905800)、长江学者和高校创新科研团队资助计划(IRT13036)、上海市高水平地方高校创新科研团队(SHSMU-ZLCX20212601)、中央高校基本科研业务费专项资金(20720210001、2072022005)等资助。参考文献:Fluid nanoporous microinterface enables multiscale-enhanced affinity interaction for tumor-derived extracellular vesicle detection. Proc. Natl. Acad. Sci. U.S.A. 2022;119(44):e2213236119. Doi:10.1073/pnas.2213236119.