核酸药物治疗可以从癌症的源头开始,通过将治疗基因导入癌细胞,纠正由基因缺陷和异常引起的癌症,从而达到治疗效果。尽管开发针对“无法靶向”和“无法用药”疾病核酸药物有很高的潜力,受到了极大的关注,但目前基因治疗的临床应用仍然受到这些核酸分子递送到靶细胞效率低的限制。细胞外囊泡(EVs)是一种细胞来源的、基于磷脂的双层膜颗粒,具有低毒、低免疫原性、能够跨越生物屏障、靶向特定类型的细胞、能够实现溶酶体逃逸等天然生物学优势,被认为是潜在的生物来源纳米药物输送系统(DDS)。近期,国家纳米科学中心杨延莲课题组在Pharmaceutics在线发表了题为“Extracellular Vesicles as Delivery Vehicles for Therapeutic Nucleic Acids in Cancer Gene Therapy: Progress and Challenges”的综述论文(2022 Oct 19;14(10):2236)。文章第一作者为国家纳米科学中心博士研究生杜蓉,通讯作者为朱凌特聘研究员、杨延莲研究员。该研究得到了国家重点研发计划、中科院战略先导计划和国家自然科学基金项目的支持。
该综述旨在概述基于EV的核酸递送系统在癌症治疗中的实例和最新进展。首先,该文介绍了EV工程化修饰的技术和方法:(1)通过改变EV来源细胞的培养模式和分离方法提高EV产量;(2)通过物理或生化方式提高核酸负载效率;(3)利用免疫检查点策略延长循环时间;(4)针对特定器官或分子改善靶向递送。之后,该文介绍了EV在递送小核酸药物的实例以及小核酸药物与其他癌症治疗方法联合治疗的应用,描述了EV递送mRNA催化前药和mRNA疫苗的设计研究,同时还阐述了针对等不同形式的CRISPR系统(如质粒、核糖核蛋白等)的EV递送,这些都为实现EV临床治疗提供了思路。以EV为载体的核酸类药物的临床转化呈上升趋势,目前已经有许多临床试验在进行中,并且即将迎来相关的EV递送的核酸药物,希望未来能够实现精准的针对性临床需求。最后,该综述讨论了EV作为核酸药物临床应用可能会遇到的一些难题:(1)大批量生产EV的质量控制以及标准的特定功能活性等产品质量评估指标的缺乏;(2)EV还无法达到核酸药物输送载体应有的包封率和载药量;(3)如何设计EV制剂保证EV递送系统的稳定性和实现长期储存;(4)目前的表征手段还无法预测、实时监测和控制EV的生物分布动态追踪等,这些问题仍需解决。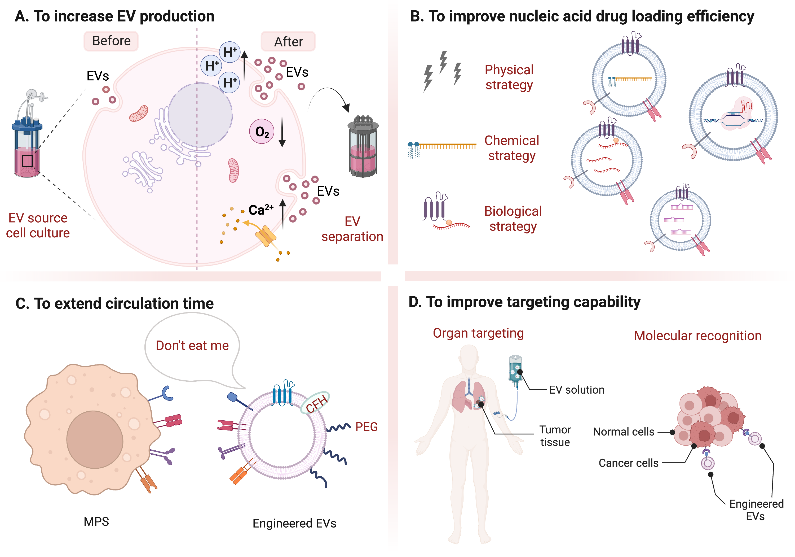
图1. 总结了根据不同目的对EV进行修饰的策略。(A)增加EV的产量;(B)提高核酸药物的载药率;(C)延长循环时间;(D)提高靶向能力。Extracellular Vesicles as Delivery Vehicles for Therapeutic Nucleic Acids in Cancer Gene Therapy: Progress and Challenges.Pharmaceutics. doi: 10.3390/pharmaceutics14102236外泌体资讯网 Pharmaceutics | 国家纳米科学中心:细胞外囊泡作为治疗性核酸载体在肿瘤基因治疗中的进展与挑战

