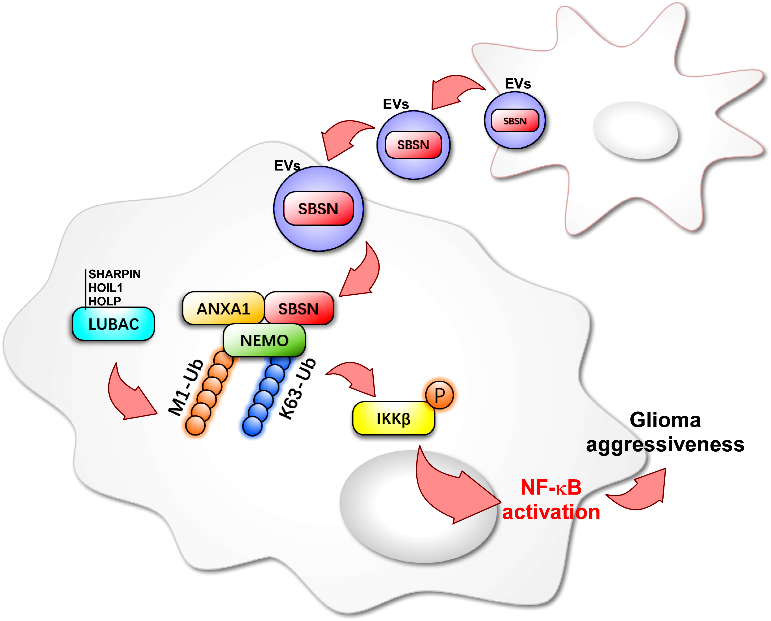
胶质瘤是最常见的原发性恶性脑肿瘤,尽管目前治疗方案已经获得显著改善,但由于胶质瘤的高度侵袭性,患者预后依然很差,探索胶质瘤侵袭相关分子机制及识别关键基因作用对胶质瘤治疗至关重要。细胞外囊泡(Extracellular vesicles,EVs)介导的细胞间通信在肿瘤进展中发挥重要作用,EVs通过介导核酸和蛋白转载促进细胞间通讯和细胞重编程,调节肿瘤恶性进展过程。近日,广州医科大学、广东省蛋白质修饰与降解重点实验室刘金保教授及蒋丽丽教授团队研究揭示了EVs介导的癌蛋白SBSN细胞间传递激活NF-kB信号通路促胶质瘤侵袭的重要机制。该研究结果以“Extracellular vesicles-transferred SBSN drives glioma aggressiveness by activating NF-kB via ANXA1-dependent ubiquitination of NEMO”为题发表在Oncogene杂志上(2022 Oct 31. doi: 10.1038/s41388-022-02520-6)。
该研究发现,癌基因SBSN在胶质瘤组织中表达上调,且表达水平与胶质瘤患者的疾病进展和不良预后密切关联。同时,通过动物模型和细胞实验,研究者在体内外确认SBSN促进肿瘤生长、侵袭和血管增生等多方面生物学作用。研究中发现,胶质瘤患者肿瘤组织中SBSN呈现明显不均一表达,研究人员进一步探讨了SBSN这种细胞间差异表达在胶质瘤进展中的生物学作用和调控。结果发现,稳定高表达SBSN的细胞培养上清(conditioned medium,CM)处理受体细胞(recipient cell),能够增强受体细胞的运动侵袭能力,有报道指出SBSN是具有分泌特性的蛋白,但研究人员发现阻断SBSN分泌并不能完全阻断CM的这种增强作用;同时,CM处理能增加受体细胞中SBSN蛋白总量,提示存在分泌特性之外的介导SBSN细胞间转运的途径。研究人员通过EVs分离、鉴定、标记及追踪系统发现,EVs能够携带SBSN并将其转运至受体细胞,进入受体细胞的SBSN在胞内与ANXA1蛋白发生结合作用,增加LUBAC复合物(HOIL-1,HOIP,SHARPIN)表达,进而增加NEMO相关K63泛素(Lys63-linked polyubiquitination,K63-Ub)和M1泛素(Met1-linear polyubiquitination,M1-Ub)表达,促进NEMO多泛素化修饰,激活NF-kB通路信号转导,促进胶质瘤侵袭。该研究结果证实EVs携带并转运SBSN蛋白在胶质瘤细胞间实现信号和功能传递,同时对胶质瘤NF-kB通路多泛素化修饰调控提供了新的理论支持。参考文献:Extracellular vesicles-transferred SBSN drives glioma aggressiveness by activating NF-κB via ANXA1-dependent ubiquitination of NEMO, Oncogene. 2022 Oct 31. doi: 10.1038/s41388-022-02520-6.
外泌体资讯网 Oncogene | 广州医科大学刘金保教授与蒋丽丽教授团队:细胞外囊泡介导癌蛋白SBSN促胶质瘤侵袭的作用和机制