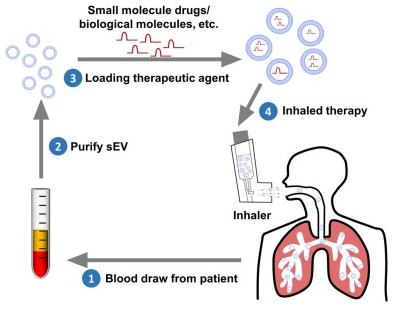
小细胞外囊泡(sEV)是一组直径小于200nm的细胞分泌的纳米囊泡。越来越多的研究表明,sEV可以反映人类疾病的发病机制,并具有潜在的给药特性。然而,通过雾化输送装载外源性小RNA的sEV的方法此前尚未报道。而且,雾化后sEV的完整性、雾化后sEV的输送效率、其在肺及相关细胞中的沉积等方面具有不确定性。来自美国乔治亚大学和查理·诺伍德VA医疗中心的研究人员提供了一种通过雾化方式进行RNA给药的sEV方案,并证明雾化的sEV及RNA主要靶向肺巨噬细胞和气道上皮细胞,实现了良好的肺部疾病治疗的靶向性。相关研究以“Nebulization of extracellular vesicles: A promising small RNA delivery approach for lung diseases”为题发表于新一期的Journal of Controlled Release杂志上。
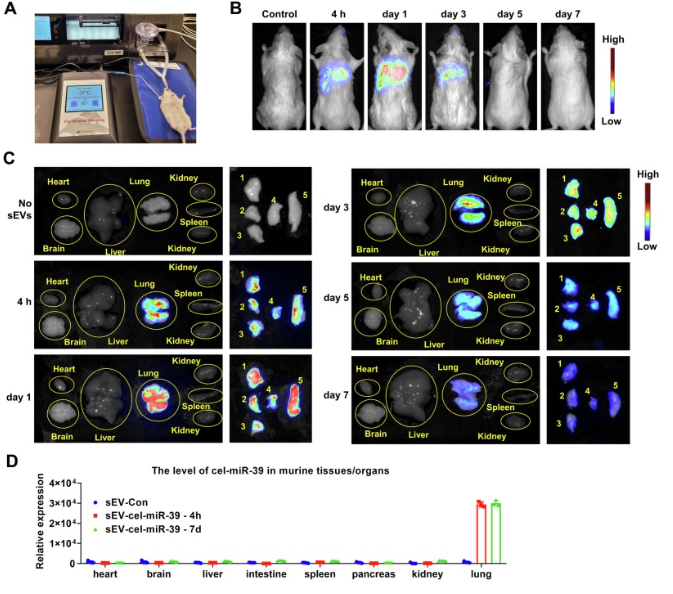
细胞外囊泡(EVs)是几乎所有哺乳动物细胞分泌到细胞外空间的膜状囊泡结构,是细胞间和器官间通信介质。传统上,EV根据其特性和生物发生过程分为微泡(ectosomes)和外泌体(exosomes)。微泡由胞质膜出芽产生,直径在100-1000 nm之间。外泌体起源于多泡体(MVBs),与质膜融合后释放,形成直径在30-150nm之间。根据EV的大小,EV可以分为直径小于200nm的小EV(sEV)和直径大于200nm的微泡、凋亡小体等中型至大型EV。sEV一词是2018年国际细胞外囊泡学会更新指南(MISEV2018)中推荐使用的,在许多研究中,sEV已经取代了传统的使用“外泌体”术语。sEV已在多种人类生物液体中检测到,包括血浆、血清、支气管肺泡灌洗液、脑脊液、尿液、母乳、羊水、唾液、腹水和胆汁。由sEV是从含有独特生物物质的各种细胞类型中释放出来的,因此sEV可以提供一系列疾病的预后信息,如癌症、慢性炎症和代谢性疾病。此外,由于sEV的结构能够包装各种不同的内容物,穿透细胞膜,并在细胞内释放其内容物,因此sEV作为药物传递疗法引起了广泛的兴趣。小干扰RNA(siRNAs)和微小RNA(miRNAs)是小的非编码RNA,在从癌症到感染等各种疾病中具有很好的潜在治疗作用。siRNA是化学合成的双链RNA分子,长度为20 - 25bp。相比之下,miRNAs是所有动物模型系统中内源性编码的非编码RNA,并调节关键的生物过程。考虑到siRNA和miRNA的治疗特性,基于siRNA和miRNA的药物的临床试验正在进行中。尽管大量证据证明了这些siRNA和miRNA的有效性,但RNA具有不稳定性和易于降解性,这样RNA的有效递送成为其治疗应用的最突出困境。吸入给药通常用于各种肺部疾病,与全身给药相比,可以潜在地增加治疗药物在肺部的滞留,毒性可以忽略不计。然而,由于粘液清除作用,高稳定性、高效率和特异性地将治疗性siRNA和miRNA运送到肺仍然是一个主要挑战。该研究团队此前的研究表明,基于sEV的siRNA和miRNA递送方法具有几个优点,包括增强稳定性和促进细胞摄取。例如,sEV中装载的siRNA和miRNA发挥了正常功能,并提高了稳定性。这使得sEV成为有前途的安全药物传递载体,因为sEV不触发先天免疫应答。气溶胶给药是一种传统的将药物送入肺部的方法,其中雾化技术目前发展迅速,雾化器在医院和家庭中被常规使用。通过雾化器,药物可以直接沉积到呼吸道,使这一途径成为一个有吸引力的选择。雾化技术的进步提供了最佳的吸入方式和高给药效率。新的雾化设备,如振动筛网雾化装置(VMN),在危重病人中得到了应用。在本研究中,研究人员使用VMN来验证sEV是否可以通过雾化方式进入肺部。研究人员使用血清来源的sEV作为RNA传递载体,并使用VMN评估装载小RNA的sEV的传递可能性。结果显示,sEV可以通过VMN输送到小鼠肺部,体内sEV追踪显示吸sEV仅分布于肺,主要定位于肺巨噬细胞和气道上皮细胞。此外,装载在sEV中的RNA被成功地运送到肺部。通过吸入装载siMyd88的sEV,减轻了脂多糖诱导的小鼠肺损伤。这项研究提出了一种新的方法,通过雾化将sEV介导的小RNA递送到小鼠肺部,并提出了一种潜在的基于sEV的人类肺部疾病治疗策略。
参考文献: Nebulization of extracellular vesicles: A promising small RNA delivery approach for lung diseases. J Control Release. 2022;352:556-569.