目前,多种药物载体(包括脂质体、胶束和纳米粒等)已被开发来改善治疗药物的缺点。然而,这些药物载体经常聚集在靶点之外,不仅对人体产生副作用,还会耗尽输送到所需位置的药物量,导致药物输送效率显著降低,无法满足预期的临床需求。因此,迫切需要找到一种更合适的药物载体,来消除传统合成纳米载体的缺点。小细胞外囊泡(sEV)具有较低的免疫原性、良好的生物相容性和内在靶向性等优良特性,在递药系统中显示出巨大的应用潜力。近日,山东大学陆榕团队和威海纽兰生物科技有限公司的研究人员对毕赤酵母细胞基因改造后获得负载阿魏酸酯酶的工程化小细胞外囊泡,并将其应用于药物活性分子阿魏酸的高效装载。该研究成果以“Engineered Small Extracellular Vesicles as a Versatile Platform to Efficiently Load Ferulic Acid via an "Esterase-Responsive Active Loading" Strategy”为题发表在Frontiers in Bioengineering and Biotechnology杂志上(doi: 10.3389/fbioe.2022.1043130)。该团队通过模块化基因工程技术对毕赤酵母细胞改造,利用自创的超速离心结合多种膜过滤方法从大规模培养液中提取出高纯度和高浓度的工程化小细胞外囊泡,并实现工程化小细胞外囊泡通过“酯酶响应主动加载”策略高效装载药物活性分子。该文通讯作者是山东大学陆榕老师,第一作者是硕士研究生满夫龙。研究团队长期研究细胞外囊泡作为新型纳米载药工具在疾病诊断、治疗中的研究与应用,已在Pharmaceutics、AAPS Pharmscitech、Journal of Biomedical Nanotechnology等国际期刊发表研究多项相关研究成果。
受脂质体纳米药物主动载药、药前设计和固定化酶等策略的启发,团队开发了一个新的工程化小细胞外囊泡平台,名为“酯酶响应型主动载药”(EAL),可用于高效、稳定的加载活性药物分子。选择广泛应用的阿魏酸酯类衍生物作为前药,建立连续的跨膜离子梯度,实现阿魏酸活性分子在小细胞外囊泡中的高载药量。结果表明,载药量和包封率分别比被动负载高约6倍和5倍。此外,团队自创的超速离心结合多种膜过滤方法可以实现大规模、高质量的小细胞外囊泡的生产。细胞外和细胞内评估实验进一步证实由EAL所制备的载阿魏酸小细胞外囊泡制剂在缓释和低毒方面的优越性能。综上所述,这些发现将为基于小细胞外囊泡的递药系统开发提供具有指导意义的见解。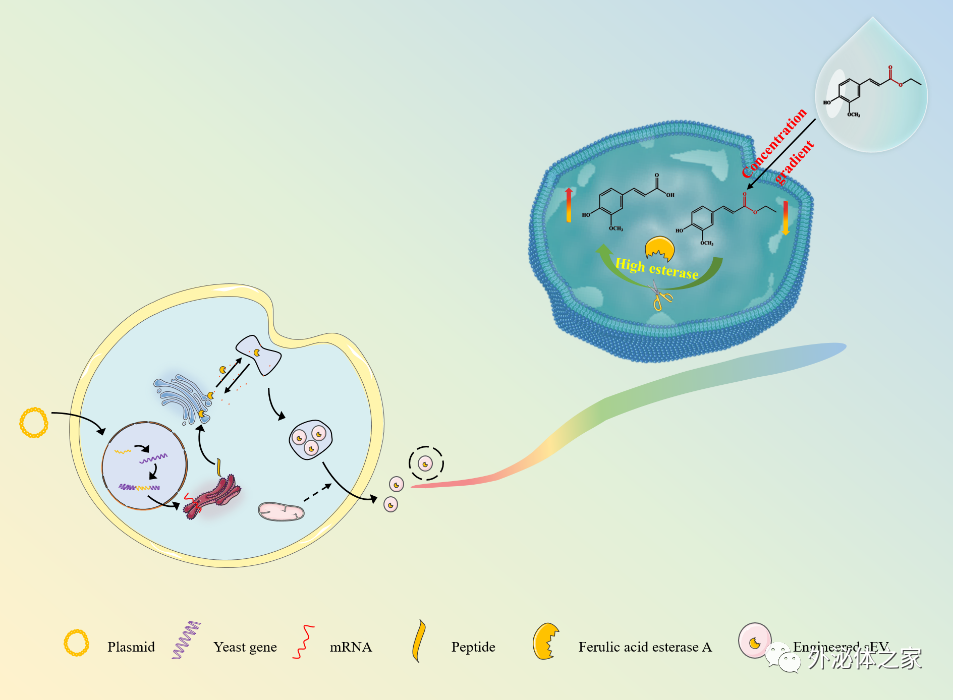
Engineered small extracellular vesicles as a versatile platform to efficiently load ferulic acid via an“esterase-responsive active loading”strategy. Front. Bioeng. Biotechnol. 10:1043130. doi: 10.3389/fbioe.2022.1043130外泌体资讯网 Front Bioeng Biotechnol丨山东大学:工程化小细胞外囊泡通过“酯酶响应主动加载”策略高效装载药物活性分子