肿瘤免疫治疗已经成为一种有效的癌症治疗手段,受到越来越多的关注。这其中肿瘤疫苗更是成为免疫治疗的研究热点。树突状细胞作为最强大的抗原提呈细胞,可作为肿瘤疫苗的载体。但是这种细胞载体生产工艺复杂,耗钱费时。同时树突状细胞进入生物体内,容易受到环境影响从而降低抗原提呈和免疫刺激能力。目前最常用的抗原靶点则是肿瘤相关抗原(TAA),肿瘤相关抗原在人体快速增殖分裂的健康组织也会表达,经常导致免疫原性下降或者带来自身免疫的风险。因此迫切需要寻找新的疫苗载体和抗原靶点,来适应个体化、精准化的肿瘤治疗要求。
近日,北京大学齐宪荣团队设计了一种新型的纳米疫苗平台,使用树突状细胞衍生的外泌体作为载体装载患者特异性新抗原(Neoantigen),用于个体化和精准化的免疫治疗。该研究成果以“Dendritic cell derived exosomes loaded neoantigens for personalized cancer immunotherapies”为题发表在Journal of Controlled Release杂志上(2022 Dec 2;S0168-3659(22)00807-0)。该文通讯作者是北京大学齐宪荣教授,第一作者是博士生李骥。
树突状细胞衍生的外泌体具备其母细胞强大的免疫属性,例如抗原提呈能力和免疫刺激功能。同时外泌体作为非细胞载体,具备了细胞载体所不具有的优势,比如更利于工业化大规模生产,在生物环境中能更好的保持其抗原提成能力,不存在细胞分裂和病毒感染等问题。而作为装载物的肿瘤新抗原,则是在基因测序和免疫筛选技术飞速发展下所得的产物。新抗原是从患者肿瘤样本中筛选出来的高度特异性,具有极强免疫原性的抗原靶点,它只在肿瘤内部表达,从而避免了使用肿瘤相关抗原在人体健康正常组织表达所带来的免疫原性下降和自身免疫风险等问题。该团队长期专注于基因药物、免疫治疗、化疗、放疗等靶向药物递送系统方面的研究和应用。已在ACS Nano, Nano Today, Biomaterials, Journal of Controlled Release, Adv. Health. Mater.等国际期刊发表研究多项相关研究成果。
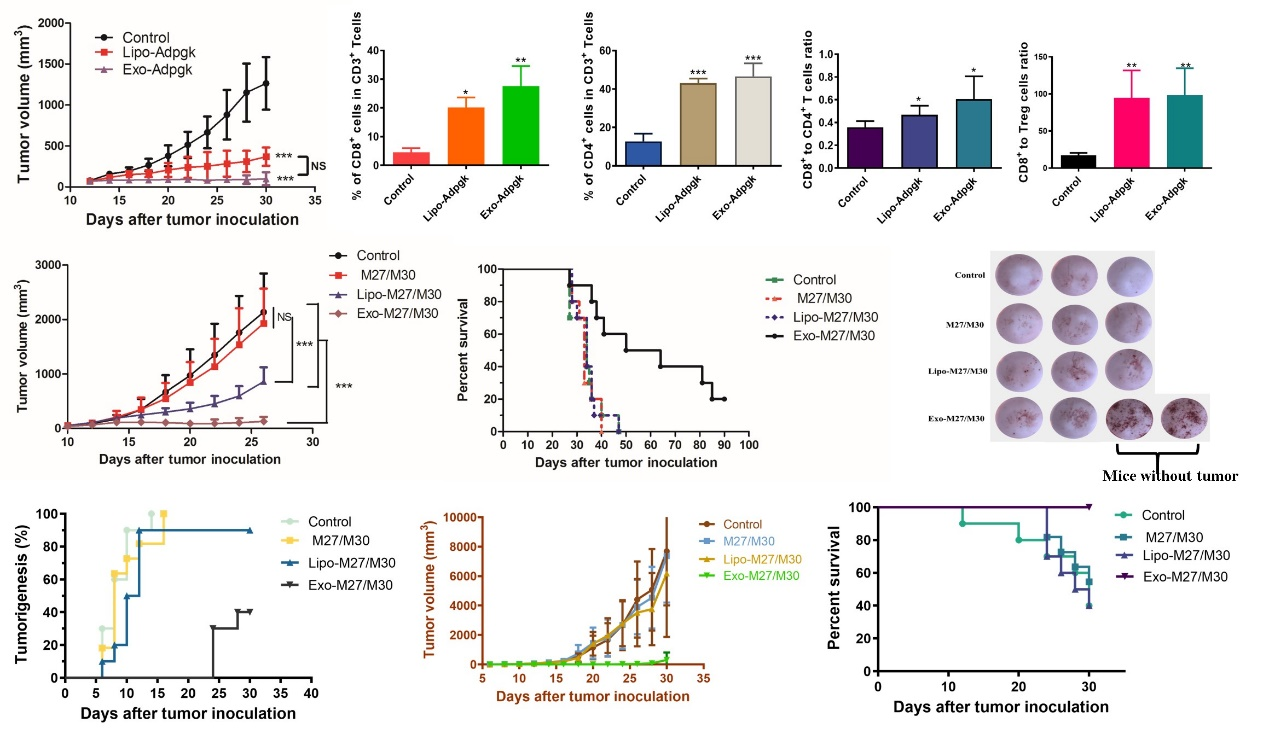
该DC来源外泌体递送系统在注射部位具有良好的储库效应和淋巴结靶向能力,在小鼠体内成功诱导抗原特异性的广谱T细胞和B细胞介导的免疫应答。新抗原-外泌体纳米疫苗体系,应用在治疗性、预防性和转移性B16F10黑素瘤以及治疗性MC-38结肠癌等小鼠肿瘤模型中,通过激发多重免疫反应,显著地抑制了多种肿瘤生长、延长了小鼠生存期,预防性的延迟了肿瘤发生并且建立了长期免疫记忆保护,并且有效消除了肺转移。机制研究表明,新抗原-外泌体纳米疫苗能够促进多种抗肿瘤免疫因子的释放,激发更多的抗肿瘤T细胞和免疫浸润到肿瘤部位发挥效应清除肿瘤,同时激活了B细胞分泌大量抗原特异性抗体,实现了体液免疫和细胞免疫的协同作用。该团队的研究构建了一种改进的非细胞肿瘤疫苗策略,提出了基于外泌体的癌症免疫治疗和个性化纳米技术平台。这些发现为快速生成个体化纳米疫苗并应用于临床开发提供了坚实的基础。
参考文献:
Dendritic cell derived exosomes loaded neoantigens for personalized cancer immunotherapies. Journal of Controlled Release 353 (2023) 423–433. (https://doi.org/10.1016/j.jconrel.2022.11.053)
外泌体资讯网 J CONTROL RELEASE | 北京大学:树突状细胞衍生的外泌体装载肿瘤新抗原用于个体化精准化肿瘤免疫治疗