生物药剂分类系统(BCS)II类和IV类药物的低溶解度,显著降低其通过口服给药抗肠道细菌感染的有效性。纳米制剂是改善药物溶解度的有效剂型,已有大量报道的无机材料、高分子材料和生物材料制备的药物递送载体用于提高BCSII类和IV类药物的溶解度和功效。然而,这些递送体系的应用通常受到细胞毒性和免疫原性的限制。外泌体作为细胞间通讯的重要介质引起了人们的强烈关注,外泌体是细胞由于环境刺激或自身激活而分泌的纳米级细胞外囊泡(EV),具有脂质膜双层结构。细胞吸收和分泌外泌体的过程是相互关联的,被多种不同的机制吸收和分泌,并特异性地作用于不同的细胞。随着靶向给药领域的快速发展,基于细胞的EV递送体系也引起了相当大的兴趣。然而,外泌体的胃肠道稳定性低和生产成本高阻碍了其作为药物载体的发展。通过比较来自不同来源的外泌体,包括细胞、细菌和牛奶,发现低成本和稳定性好的牛奶外泌体(mExo)更具有作为口服药物递送载体开发的潜力。近日,中国农业大学朱奎教授团队以Supplementary Cover的形式在Journal of Agricultural and Food Chemistry杂志发表题为“Milk exosomes facilitate oral delivery of drugs against intestinal bacterial infections”的研究性论文 (2022, doi: 10.1021/acs.jafc.2c04971),拓展mExo在口服给药抗肠道细菌感染方面的应用范围,揭示mExo在提高药物溶解度以增强口服给药疗效方面的潜力。曲少奇博士和博士研究生韩益明为论文第一作者,朱奎教授为论文通讯作者。这项工作得到岭南现代农业实验室(NT2021006)、国家自然科学基金(31922083)等资助。
在这项研究中,研究人员通过尺寸排阻色谱法从牛奶中成功分离出mExo,并进一步通过磷脂酰丝氨酸进行修饰,制备功能化mExo。随后在体外实验中验证了mExo能够提升α-倒捻子素药物溶解度1000倍以上,并发挥延缓药物释放和抗菌的作用。接着采用transwell系统评价mExo穿透肠道黏液屏障的能力,发现其具有显著增强药物穿透黏液屏障的能力。基于磷脂酰丝氨酸介导的“eat me”信号主动靶向巨噬细胞,随后通过耐甲氧西林金黄色葡萄球菌和万古霉素耐肠球菌感染巨噬细胞,评价了功能化外泌体抗胞内菌的能力,结果显示有效地降低了胞内菌载量。最后,在小鼠肠道感染模型和鸡坏死性肠炎模型中,与游离抗菌药物相比均显示出显著的治疗效果。综上,该研究发现高生物相容性的mExo大幅度提高α-倒捻子素溶解度,显著提升抗肠道感染疗效,为提升BCS II和IV类药物溶解度提供技术支撑。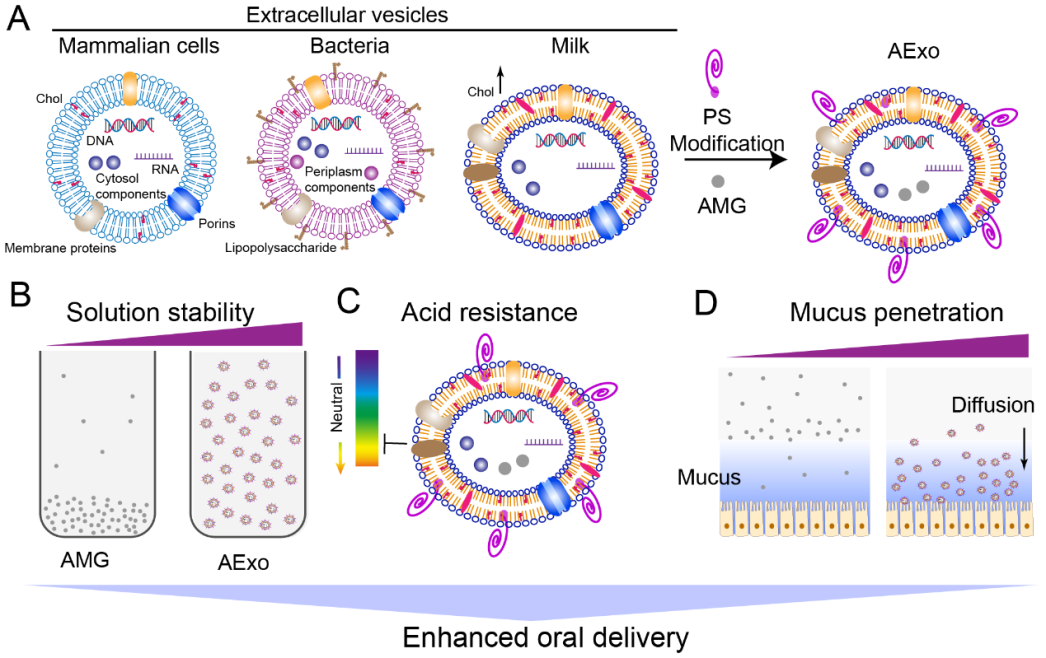
Milk exosomes facilitate oral delivery of drugs against intestinal bacterial infections.Journal of Agricultural and Food Chemistry. 2022, Doi: 10.1021/acs.jafc.2c04971.外泌体资讯网 J AGR FOOD CHEM | 中国农业大学朱奎教授团队:牛奶外泌体促进口服药物递送以抵抗肠道细菌感染

