细胞外囊泡(EVs)是一种很有前途的化学和生物药物的载体。然而,由于EV缺乏细胞特异性,其用于疾病治疗的疗效受到限制。现有的提高EV组织特异性的方法主要依赖于蛋白质和多肽的表面显示,但在很大程度上忽略了构成EV最外层的致密糖萼的价值。来自瑞典卡罗林斯卡学院的研究人员报道了一种可重构的糖工程策略,可以内源性地在EV表面显示感兴趣的糖萼(唾液酸路易斯抗原和路易斯抗原),这些工程化EV的糖萼轮廓修饰增强了其对内皮细胞和树突状细胞的靶向特异性。相关研究以“Cell-specific targeting of extracellular vesicles though engineering the glycocalyx”为题发表于12月3日的J Extracell Vesicles杂志上。
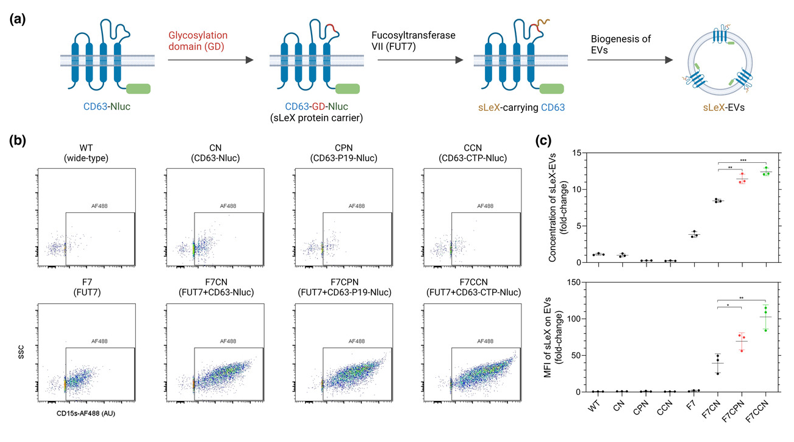
图:唾液酸路易斯抗原在EV表面的标记展示策略。
细胞外囊泡(EV)是所有细胞分泌的脂质双层膜封闭颗粒,膜结构能够保护EV腔内的对环境敏感的核酸,并在表面呈现出功能性配体。这些突出的特性促进了EV用于疾病疗法的发展。据报道,来自间充质干细胞(MSCs)、嵌合抗原受体T细胞和自然杀伤细胞等已被证明具有临床益处的细胞,他们分泌的原生EV携带功能负载分子,并自行发挥治疗作用。此外,治疗性EV囊泡的另一种产生途径是通过使用各种内源性和外源性方法的EV工程实现的。
尽管在以定制方式生产EV方面取得了进展,但基于EV的治疗面临的一个普遍障碍是对靶细胞的特异性相对较低。因此,EV表面已被广泛定制,增强被靶细胞识别能力,展示出能被靶细胞识别的的功能成分。这通常可以通过EV产生细胞的基因工程来实现,以表达由感兴趣成分和EV分选膜蛋白(如Lamp2b或PTGFRN)组成的融合蛋白等。或者,通过在生物正交条件下或非共价缔合的化学反应,将靶向部分合并到预分离的EV中。例如,合成肽CP05被确定为EV表面蛋白CD63的强结合剂,将CP05偶联到外源标记EV生成的靶向配体,这些配体成功用于细胞靶向上。
到目前为止,几乎所有EV表面展示策略都集中在蛋白质和肽配体的使用上,而形成EV最外层的致密糖萼涂层在很大程度上被忽视了。事实上,糖工程已经显示出提高过继细胞疗法疗效的希望。例如,表达CD22糖基配体的自然杀伤细胞对白血病B细胞的亲和力和活性高于非靶向细胞。在EV的糖工程方面,早期的两项研究使用酶解修饰了表面聚糖,并发现细胞摄取和生物分布特征发生了显著变化,突出了表面聚糖的功能相关性。然而,酶去糖基化受到操纵指定糖基以实现细胞靶向所需的灵活性的限制。
唾液酸路易斯抗原(Sialyl Lewis-X,sLeX)是E-选择素的四糖配体。sLeX由白细胞表达,并参与炎症期间白细胞粘附到表达E-选择素的内皮细胞。sLeX靶向活化内皮细胞的能力已被用于改善合成纳米颗粒如脂质体和微泡对炎症病变的积累。在这些研究中,sLeX外源结合到颗粒表面,需要通过纯化进一步去除未共轭聚糖,这可能是大规模生产存在的问题。相比之下,通过对EV产生细胞进行基因工程,靶向配体可内源性分选到EV上,无需进行纯化程序。在这项研究中,研究人员使用基因工程方法在EV表面表达sLeX和LeX,并表征其靶向激活内皮细胞的能力。
研究人员在EV产生细胞中,通过基因工程共同表达一个糖基化结构域(GD),该结构域插入CD63和焦点转移酶VII(FUT7)或IX(FUT9)的细胞外区域外围,因此工程化EV可以展示出感兴趣的聚糖。通过这一策略,研究人员展示了两种类型的糖基配体,唾液酸路易斯抗原(sLeX)和路易斯抗原(LeX)在EV上的表面展示,并分别实现了对激活的内皮细胞和靶向表达DC-SIGN蛋白的树突状细胞的高特异性。此外,slex-EV的内皮细胞靶向特性与间充质干细胞的内在治疗作用相结合,减少了内皮损伤。总之,本研究提出了一种可重构的糖工程策略,生产具有强细胞特异性的EV,并强调了糖萼作为工程化EV的可开发特性。
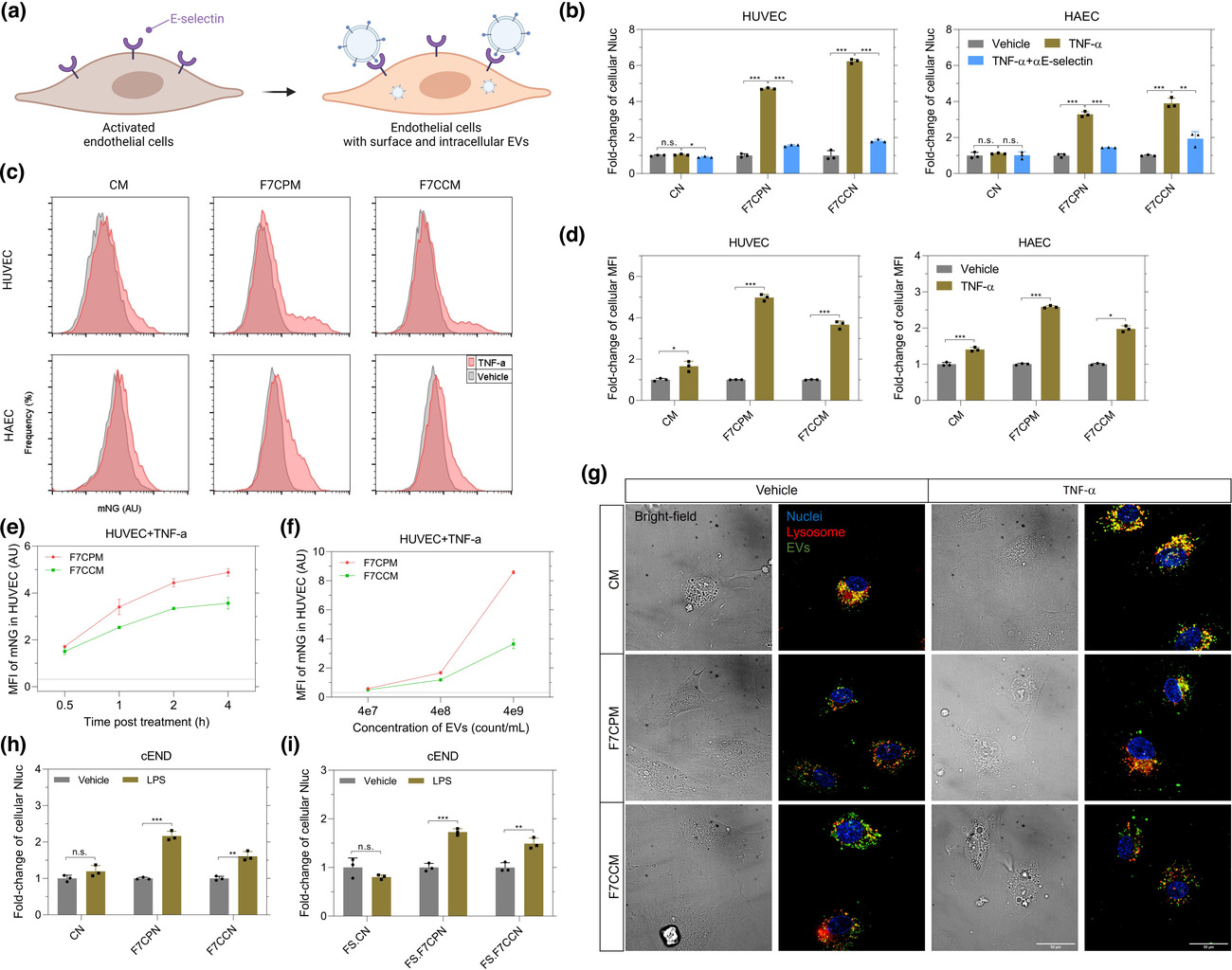
图:sLeX-EV被内皮细胞特异性摄取的检测。
参考文献:Cell-specific targeting of extracellular vesicles though engineering the glycocalyx. J Extracell Vesicles. 2022 Dec;11(12):e12290.
JEV丨通过工程化糖萼修饰细胞外囊泡用于增强细胞靶向性
土豆
细胞外囊泡(EVs)是一种很有前途的化学和生物药物的载体。然而,由于EV缺乏细胞特异性,其用于疾病治疗的疗效受到限制。现有的提高EV组织特异性的方法主要依赖于蛋白质和多肽的表面显示,但在很大程度上忽略了构成EV最外层的致密糖萼的价值。来自瑞典卡罗林斯卡学院的研究人员报道了一种可重构的糖工程策略,可以内源性地在EV表面显示感兴趣的糖萼(唾液酸路易斯抗原和路易斯抗原),这些工程化EV的糖萼轮廓修饰增强了其对内皮细胞和树突状细胞的靶向特异性。相关研究以“Cell-specific targeting of extracellular vesicles though engineering the glycocalyx”为题发表于12月3日的J Extracell Vesicles杂志上。
图:唾液酸路易斯抗原在EV表面的标记展示策略。
细胞外囊泡(EV)是所有细胞分泌的脂质双层膜封闭颗粒,膜结构能够保护EV腔内的对环境敏感的核酸,并在表面呈现出功能性配体。这些突出的特性促进了EV用于疾病疗法的发展。据报道,来自间充质干细胞(MSCs)、嵌合抗原受体T细胞和自然杀伤细胞等已被证明具有临床益处的细胞,他们分泌的原生EV携带功能负载分子,并自行发挥治疗作用。此外,治疗性EV囊泡的另一种产生途径是通过使用各种内源性和外源性方法的EV工程实现的。
尽管在以定制方式生产EV方面取得了进展,但基于EV的治疗面临的一个普遍障碍是对靶细胞的特异性相对较低。因此,EV表面已被广泛定制,增强被靶细胞识别能力,展示出能被靶细胞识别的的功能成分。这通常可以通过EV产生细胞的基因工程来实现,以表达由感兴趣成分和EV分选膜蛋白(如Lamp2b或PTGFRN)组成的融合蛋白等。或者,通过在生物正交条件下或非共价缔合的化学反应,将靶向部分合并到预分离的EV中。例如,合成肽CP05被确定为EV表面蛋白CD63的强结合剂,将CP05偶联到外源标记EV生成的靶向配体,这些配体成功用于细胞靶向上。
到目前为止,几乎所有EV表面展示策略都集中在蛋白质和肽配体的使用上,而形成EV最外层的致密糖萼涂层在很大程度上被忽视了。事实上,糖工程已经显示出提高过继细胞疗法疗效的希望。例如,表达CD22糖基配体的自然杀伤细胞对白血病B细胞的亲和力和活性高于非靶向细胞。在EV的糖工程方面,早期的两项研究使用酶解修饰了表面聚糖,并发现细胞摄取和生物分布特征发生了显著变化,突出了表面聚糖的功能相关性。然而,酶去糖基化受到操纵指定糖基以实现细胞靶向所需的灵活性的限制。
唾液酸路易斯抗原(Sialyl Lewis-X,sLeX)是E-选择素的四糖配体。sLeX由白细胞表达,并参与炎症期间白细胞粘附到表达E-选择素的内皮细胞。sLeX靶向活化内皮细胞的能力已被用于改善合成纳米颗粒如脂质体和微泡对炎症病变的积累。在这些研究中,sLeX外源结合到颗粒表面,需要通过纯化进一步去除未共轭聚糖,这可能是大规模生产存在的问题。相比之下,通过对EV产生细胞进行基因工程,靶向配体可内源性分选到EV上,无需进行纯化程序。在这项研究中,研究人员使用基因工程方法在EV表面表达sLeX和LeX,并表征其靶向激活内皮细胞的能力。
研究人员在EV产生细胞中,通过基因工程共同表达一个糖基化结构域(GD),该结构域插入CD63和焦点转移酶VII(FUT7)或IX(FUT9)的细胞外区域外围,因此工程化EV可以展示出感兴趣的聚糖。通过这一策略,研究人员展示了两种类型的糖基配体,唾液酸路易斯抗原(sLeX)和路易斯抗原(LeX)在EV上的表面展示,并分别实现了对激活的内皮细胞和靶向表达DC-SIGN蛋白的树突状细胞的高特异性。此外,slex-EV的内皮细胞靶向特性与间充质干细胞的内在治疗作用相结合,减少了内皮损伤。总之,本研究提出了一种可重构的糖工程策略,生产具有强细胞特异性的EV,并强调了糖萼作为工程化EV的可开发特性。
图:sLeX-EV被内皮细胞特异性摄取的检测。
参考文献:Cell-specific targeting of extracellular vesicles though engineering the glycocalyx. J Extracell Vesicles. 2022 Dec;11(12):e12290.
外泌体资讯网 JEV丨通过工程化糖萼修饰细胞外囊泡用于增强细胞靶向性