小胞外囊泡(sEVs)由所有类型的细胞释放,并已成为细胞间通信的关键介质。虽然许多研究已经揭示了sEVs在健康和疾病中的作用,但由于缺乏合适的成像技术,sEVs生物发生和摄取的确切机制仍未被探索。对于sEVs功能研究,成像长期依赖于传统的荧光显微镜,但受限于低分辨率。超分辨率显微镜技术的最新发展,特别是单分子定位显微镜(SMLM),有希望用于揭示纳米水平的亚细胞细节。来自德国埃森大学医院的研究人员基于SMLM的优良闪烁特性的适当荧光团,着重介绍了SMLM的基本原理,并综述了SMLM在sEV生物学中的应用现状。相关研究以“Single Molecule Localization Microscopy for Studying Small Extracellular Vesicles”为题发表于1月12日的Small杂志上。
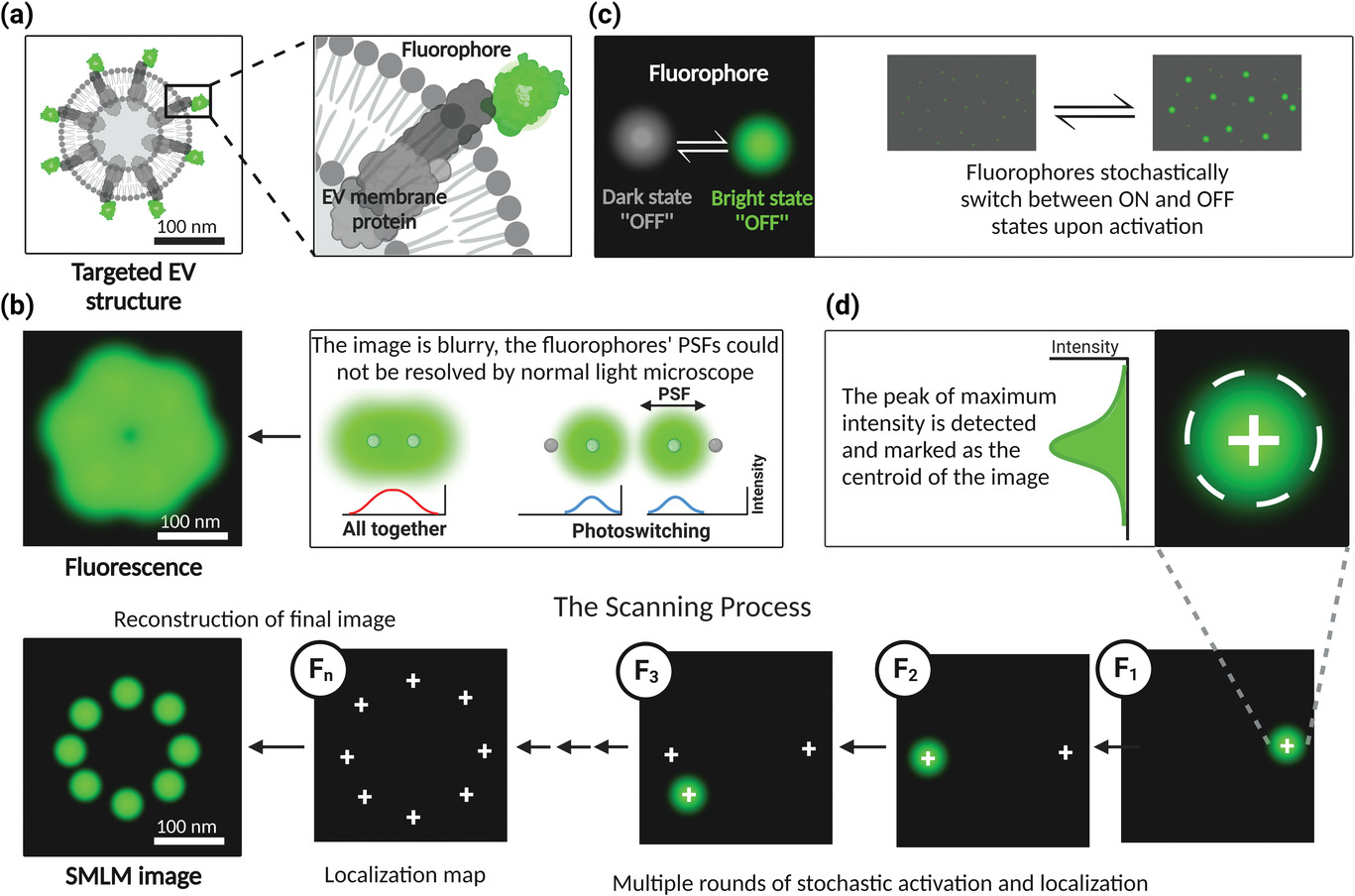
图:单分子定位显微镜原理。a)可切换荧光纳米基团标记的sEV。b)用光学显微镜成像的荧光分子(绿点)表现为一个模糊点,通常称为点扩散函数(PSF),扩展到获取图像中的多个像素。c) SMLM利用荧光团在活跃状态和一个或多个非活跃状态之间进行随机切换。d)在SMLM中,检测最大强度的峰值并标记为图像的质心,以确定发射荧光团的确切位置。
细胞外囊泡(EVs)是所有类型细胞分泌到细胞外空间的脂质双分子结合囊泡。EV大致分为三种主要类型,包括外泌体(30-150 nm)、微囊泡(150-1000 nm)和凋亡小体(1-5µm)。EV是非常异质性的,MISEV2018指南建议EV研究人员使用术语小EV(sEVs)来表示直径小于200 nm的囊泡。sEV包含许多基本的货物生物分子,如核酸(DNA、mRNA、microRNA)、蛋白质和脂质。sEV已成为健康和疾病状态下细胞之间通信的功能介质。来源于肿瘤细胞的sEV含有疾病特异性蛋白、RNA和双链DNA(dsDNA),代表疾病状态和进展。特别是在肿瘤微环境中,sEVs将其货物从肿瘤转移到基质细胞。sEVs在许多其他疾病中也发挥病理生理作用,包括神经退行性疾病和各种感染,同时传递调节许多生物过程并影响免疫系统。
在过去十年中,关于sEV生物发生途径和sEV在健康和疾病中的作用的研究呈指数级增长。然而,由于缺乏使用改进成像技术的显微研究,在远端受体细胞中探索释放的sEV及其货物与细胞生物分子的相互作用研究受到了严重阻碍。目前大多数涉及sEV的显微研究使用传统的共聚焦显微镜,使用Imaris生成2D或3D重建图像。虽然这些图像提供了sEV通信的相关信息,但它们无法解决sEV相关货物在200-300 nm范围内与细胞生物分子的精确定位和相互作用。利用共聚焦成像,研究人员最近发现了来源于急性髓系白血病(AML)的EV-DNA与来源于骨髓的间充质基质细胞(BM-MSCs)相互作用。然而,使用2D共聚焦成像,我们无法准确地识别AML EV-DNA如何与骨髓间充质干细胞中的哪些细胞生物分子通信。因此,有必要应用具有创新标记策略的超分辨率显微镜(SRM),使光学分辨率达到纳米范围,实时研究sEVs与受体细胞中各种组分的生物分子相互作用。
在各种SRM技术中,单分子定位显微镜(SMLM)主要用于EV研究,因为SMLM具有优异的分辨率和较高的信噪比,有助于对单分子的排列进行空间量化。然而,EV研究人员大多仅通过使用与不同荧光团相连的抗体标记常见的sEV标记来实现SMLM。因此,利用SRM在远端受体细胞中研究sEV功能作用的研究非常有限。在这方面,研究人员尝试使用SMLM研究sEV相关DNA货物与远端受体细胞中细胞成分的相互作用。然而,由于常用的荧光团的一些限制,相关研究仍然面临着一些挑战。
在这篇综述中,根据以往研究的经验,研究人员讨论了现有标记荧光基团的缺陷和局限性,以及在SMLM sEV成像中应用具有特殊闪烁特性的替代荧光团的必要性。通过应用不同的标记策略来研究sEV的生物发生及其与远处受体细胞的生物分子相互作用,讨论如何将用于细胞成像的SMLM技术转化到sEV成像中。此外,研究人员总结了在纳米级分辨率下sEV的活细胞和固定细胞成像的未来进展,如何解决sEV生物学中的关键问题,例如将不同的生物分子货物包装到sEV中、单个sEV的摄取、以及sEV与特定细胞隔室的分子相互作用。
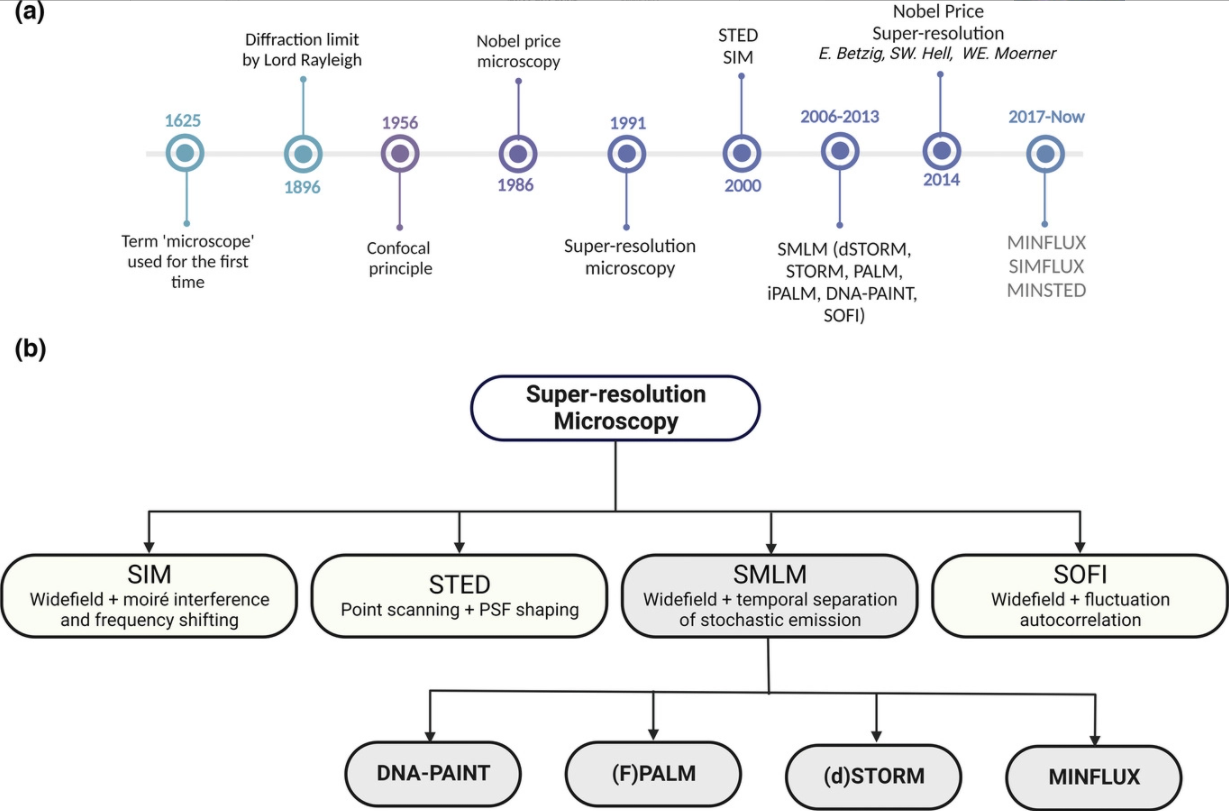
超分辨率显微技术示意图。a)光学显微镜领域的重大突破时间轴。b)SMLM方法是基于连续成像荧光团的稀疏信号,并从获得的衍射模式计算它们的位置。
参考文献:Single Molecule Localization Microscopy for Studying Small Extracellular Vesicles. Small. 2023 Jan 12: e2205030.