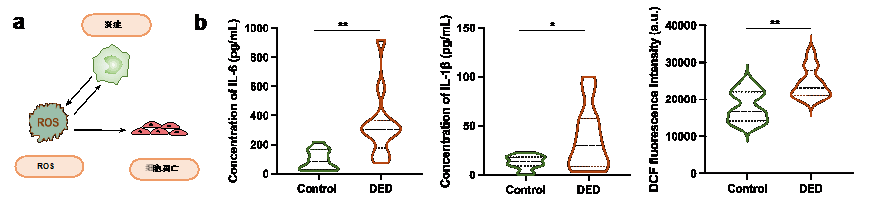
干眼症(Dry eye diseases,DED)是眼表的一种多因素疾病,其中炎症和活性氧(Reactive oxygen species,ROS)相互促进,形成恶性循环;ROS导致细胞内脂质过氧化和异常的蛋白化反应,并导致细胞的凋亡(图1a)。目前的治疗方法,包括轻度DED适用的人工泪液,中度至重度DED适用的糖皮质激素和免疫抑制剂联合使用,可以暂时缓解眼表症状并控制眼表炎症。然而,这些策略不能带来根治和/或引起副作用。因此,迫切需要开发一种治疗DED的新策略。
图1 (a)干眼症中炎症、ROS和细胞凋亡之间的关系;(b)干眼症患者眼泪中的IL-6和IL-1β以及结膜细胞中的ROS表达。
近日,首都医科大学附属北京朝阳医院眼科陶勇研究团队基于DED患者泪液中炎症因子、结膜细胞ROS表达升高及眼表损伤的临床发现(图1 b),创建了一种多效纳米颗粒--外泌体偶联抗坏血酸,通过抗炎、促修复以及清除ROS联合治疗DED,在体外实验及苯扎氯铵(BAC)诱导的干眼症小鼠模型上具有显著效果,为干眼症提供了新型治疗方式。相关工作发表于Nanoscale(A Synergistic Therapeutic Nano Eyedrop for Dry Eye Disease Based on Ascorbic Acid-Coupled Exosomes, Nanoscale, 2023, DOI: 10.1039/D2NR05178H)。
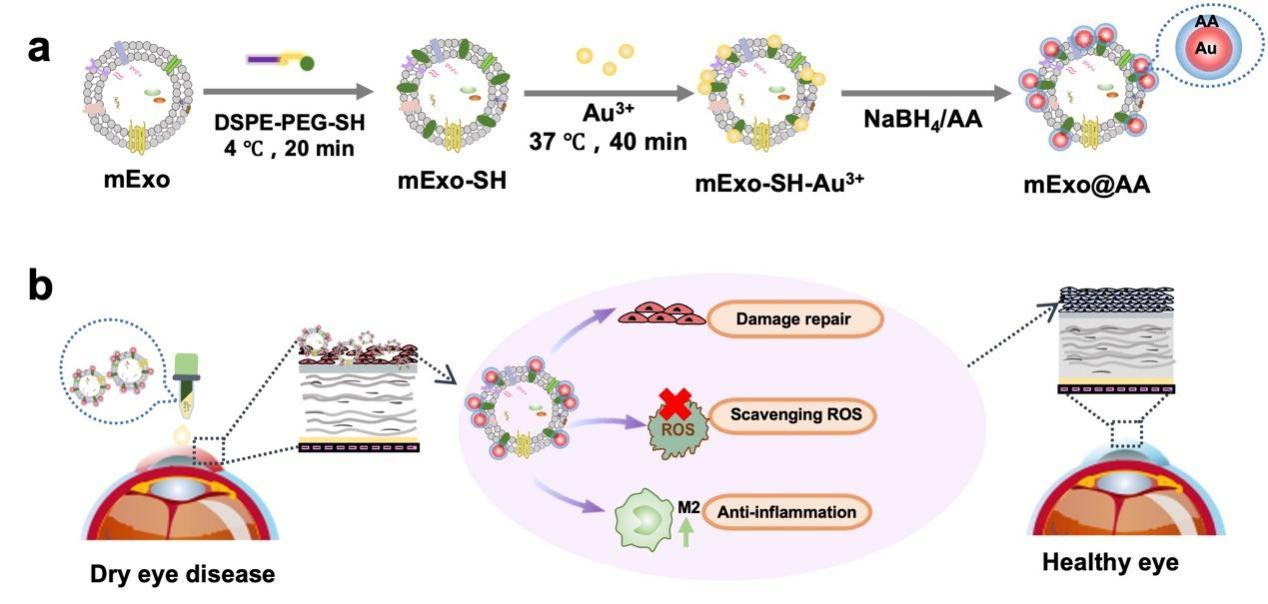
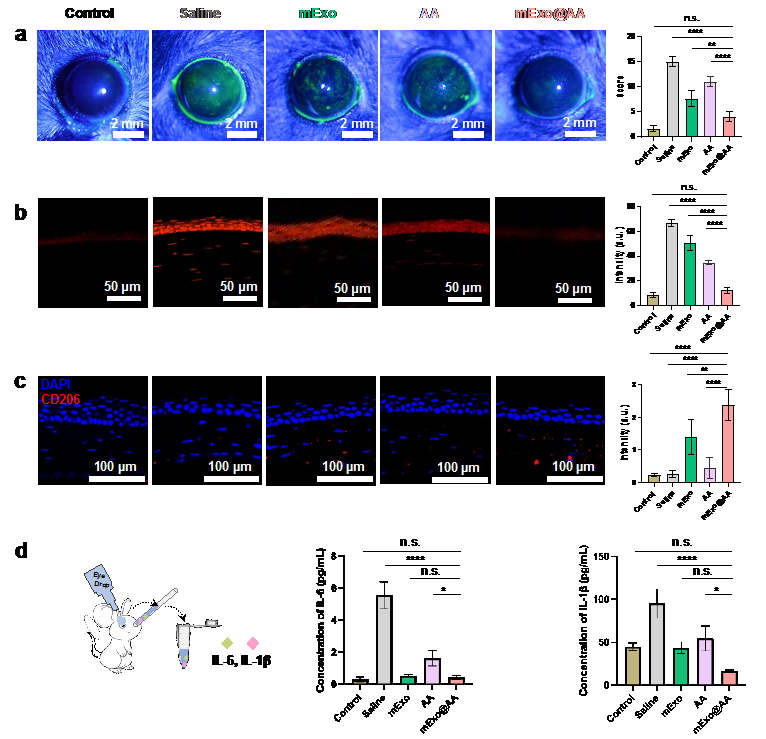
在这项工作中,研究团队选用间充质干细胞外泌体(mExo)以发挥抗炎、促修复作用,泪液中天然存在的抗坏血酸(AA)以实现清除ROS的目的。在mExo负载AA的方式上,未选用传统的超声处理、共孵育或电穿孔等方式,而是将金纳米颗粒作为linker,AA作为金纳米颗粒的配体间接偶联到mExo的表面(mExo@AA)(图2)。该制备方法过程简单、负载效率高、且不会破坏外泌体的形貌,ROS的清除效率可以达到80%。mExo@AA可以干预干眼症的多种病理过程且具有良好的生物安全性,避免了治疗效果欠佳及多次使用药物导致的副作用等问题。为了研究mExo@AA的实际性能,研究团队将mExo@AA滴眼液滴加到在BAC诱导的干眼小鼠模型中,mExo@AA表现出最佳的角膜上皮修复、ROS清除效果和最低的炎症表达(图3)。
图2 mExo偶联AA的示意图
图3 动物实验效果验证:(a)促角膜上皮修复;(b)角膜ROS清除;(c)M2细胞;(d)小鼠眼泪中炎症因子(IL-6、IL-1β)的表达。
综上所述,该研究证明外泌体偶联抗坏血酸(mExo@AA)有望作为干眼症的有效治疗药物。但由于DED的复杂性,mExo@AA对DED的具体作用机制还有待探索。此外,上述成果仍属于小动物水平的研究,大动物临床前研究和实际临床疗效也仍有待进一步的研究。鉴于已有的间充质干细胞外泌体的临床研究及抗坏血酸的天然安全性,该干眼症药物具有进一步临床转化的潜力。
该工作是该团队基于以往的研究基础,在眼表疾病治疗领域的新突破。马芳博士、冯婧博士为该论文的共同第一作者,首都医科大学附属北京朝阳医院为第一完成单位,陶勇教授为通讯作者。相关工作得到了国家自然科学基金、中国博士后科学基金、北京市医院管理局登峰计划、顺义区“北京市科技成果转化协调与服务平台”建设基金、北京市医院管理局青苗计划、广东省基础与应用基础研究基金的支持。
参考文献:
A synergistic therapeutic nano-eyedrop for dry eye disease based on ascorbic acid-coupled exosomes, Nanoscale. 2023 Jan 6. doi: 10.1039/d2nr05178h.